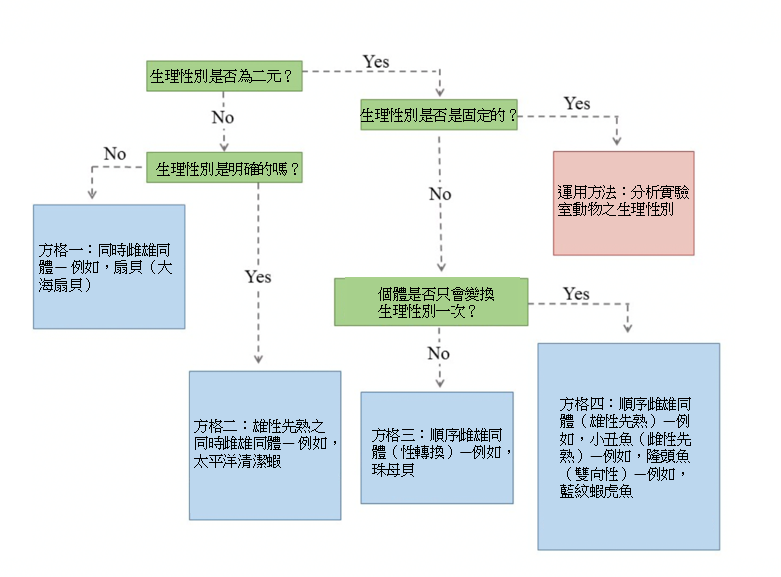
在分析有雌雄同體狀態的物種之生理性別時,須依循的方法程序與分析實驗室動物之生理性別時相同。然而,當生理性別不是二元且穩定時,要分析生理性別對於個體對環境壓力之反應的影響時就更為複雜了。其中的考量需要有對於生理性別變異的了解,以及任何生理性別變化過程的時機、變化方向與驅動力。
研究人員必須在其研究設計與分析中為雌雄同體做出說明。雌雄同體的類別可能需要再進一步完善,依據所關注之物種或個體如何分配資源給各個生理性別,以及這會如何隨時間變化而定。研究人員可能需要採用流動的生理性別分類——透過隨著生理學、生物化學、行為及基因之多樣互動過程連續狀態來定義。
方格一–同時雌雄同體在同一個成年個體中同時含有雄性與雌性之配子。一個常見的例子就是大海扇貝,其雙色的卵即是卵母細胞(橘色組織)與精子細胞(乳白色組織)所形成的(Paz et al., 2005)。在同時雌雄同體中,對於各生理性別配子的繁殖投入分配比例於個體生命週期間可能會有變化(Janicke et al., 2013; Leonard, 2013);因此生理性別對於整個生物體之能量的影響將會取決於單一個體內的雌雄組織平衡。分析同時雌雄同體者之生理性別時,必須考量單一個體中定義下的生理性別組織之比例,以及組織的生理性別是如何決定整個生物體的反應。
 大海扇貝。雙色卵代表著其雌(橘色)與雄(乳白色)配子。圖片版權 CC0 1.0 Universal
大海扇貝。雙色卵代表著其雌(橘色)與雄(乳白色)配子。圖片版權 CC0 1.0 Universal
方格二–太平洋清潔蝦為雄性先熟之同時雌雄同體——牠們會先發展成雄性,接著轉換性別為同時雌雄同體(Fiedler, et al., 2010)。隨著性別轉換後,個體之性腺內會同時含有雌雄組織並製造兩種性別的配子。這類生物體的生理性別分析必須包含其性別轉換過程對於該生物體之於環境壓力的反應之影響。為了瞭解雄性與雌雄同體暴露於壓力下的反應差異,研究人員必須清楚交待雌雄同體內的雌雄組織的影響、配子與細胞突起,及它們在整個生物體中是如何互動的。此外,如同所有同時雌雄同體的情況,其比較亦應交待單一個體分配給各生理性別組織之製造的能量儲存與組織體積比例(Janicke et al., 2013; Leonard, 2013),如若可能的話(例如,雌性是怎麼樣的雌雄同體?)。
 https://creativecommons.org/licenses/by/3.0/deed.en太平洋清潔蝦為雄性先熟雌雄同體。牠們成年時先是雄性,而後再轉變為雌雄同體。Photo credit: Lonnie Huffman.
https://creativecommons.org/licenses/by/3.0/deed.en太平洋清潔蝦為雄性先熟雌雄同體。牠們成年時先是雄性,而後再轉變為雌雄同體。Photo credit: Lonnie Huffman.
方格三–珠母貝一般來說會先發展成為雄性後才轉變為雌性(Adzigbli, et al., 2019)。然而,性別倒轉也可能因為環境因素而又接著發生,其生理性別比例是與季節有所關聯的(Southgate & Lucas, 2011)。此外,此物種之珍珠的生成與品質(Adzigbli, et al., 2019),以及其隨之而來的經濟價值亦取決於其生理性別。雄性生成的珍珠品質較優良。針對如珠母貝一類之物種的生理性別分析,考量其多次性別倒轉的可能性,必須要調查其決定生理性別的機轉,以及其可能發生多次的性別轉換如何影響單一個體的表現,例如珍珠的生成、成長,或是繁殖。
方格四–順序雌雄同體可以是雄性先熟(雄變雌),如小丑魚(Casas et al., 2016);雌性先熟,如隆頭魚(Munday et al., 2006);或雙向性的(性轉換由原先的生理性別單向變化),如藍紋蝦虎魚(Rodgers et al., 2007)。雖然其生理性別是明確的,且隨著性別轉換,個體會變為另一種性別完整地運作,然單一個體中的性別轉換過程之發生有著多樣的時段框架(Lamm et al., 2015)。例如鈍頭錦魚,將群體內的優勢終期雄性從珊瑚礁中移除,會誘使大型雌魚變換性別(Lamm et al., 2015)。然而,雖然此雌魚的行為在幾分鐘之內就會變化成雄魚的典型,但其性腺的轉變需要一到二週的時間(Lamm et al., 2015)。單一個體在此性別轉換過程當中如何應對壓力,是個還未以生理性別分析與氣候變遷角度進行探究之領域。


順序雌雄同體魚類。
A)雄性先熟雌雄同體二帶雙鋸魚。photo credit: Mal B,https://creativecommons.org/licenses/by-nd/2.0/
B)雌性先熟雌雄同體鈍頭錦魚。photo credit: Kevin Bryant,https://creativecommons.org/licenses/by-nd/2.0/
C)雙向性雌雄同體藍紋蝦虎魚。photo credit: Richard Ling,https://creativecommons.org/licenses/by-nc-nd/2.0/
相關案例分析
參考資料
Adzigbli, L., Wang, Z., Lai, Z., Li, J., &Deng, Y. (2019). Sex determination in pearl oyster: a mini review. Aquaculture Reports, 15. https://doi.org/10.1016/j.aqrep.2019.100214
Casas, L., Saborido-Rey, F., Ryu, T., Michell, C., Ravasi, T., & Irigoien, X. (2016). Sex change in clownfish: molecular insights from transcriptome analysis. Scientific reports, 6. https://doi.org/10.1038/srep35461
Fiedler, G. C., Rhyne, A. L., Segawa, R., Aotsuka, T., & Schizas, N. V. (2010). The evolution of euhermaphroditism in caridean shrimps: a molecular perspective of sexual systems and systematics. BMC evolutionary biology, 10(1), 297.
Janicke, T., Marie‐Orleach, L., De Mulder, K., Berezikov, E., Ladurner, P., Vizoso, D. B., & Schärer, L. (2013). Sex allocation adjustment to mating group size in a simultaneous hermaphrodite. Evolution, 67(11), 3233-3242.
Lamm, M. S., Liu, H., Gemmell, N. J., & Godwin, J. R. (2015). The need for speed: neuroendocrine regulation of socially-controlled sex change. Integrative and Comparative Biology, 55(2), 307-322.
Leonard, J. L. (2013). Williams' paradox and the role of phenotypic plasticity in sexual systems. Integrative and comparative biology, 53(4), 671-688.
Munday, P. L., Wilson White, J., & Warner, R. R. (2006). A social basis for the development of primary males in a sex-changing fish. Proceedings of the Royal Society B: Biological Sciences, 273(1603), 2845-2851.
Paz, M., Torrado, M., Korochkin, L. I. and Mikhailov, A. T. (2005). Esterase-like and fibronectin-like polypeptides share similar sex-cell-biased patterns in the gonad of hermaphroditic and gonochoric species of bivalve mollusks. Cell and tissue research, 322(3), 475-489.
Rodgers, E. W., Earley, R. L., & Grober, M. S. (2007). Social status determines sexual phenotype in the bi‐directional sex changing bluebanded goby Lythrypnus dalli. Journal of Fish Biology, 70(6), 1660-1668.
Southgate, P., & Lucas, J. (Eds.). (2011). The Pearl Oyster. Oxford: Elsevier.