
環境化學物質:
健康和生物醫學研究設計
摘要
歐盟委員會要求以性別化創新的研究計畫分析其框架計畫七(FP7)中的數個子計畫。本個案研究旨在探討「環境化學品對女性生殖系統之影響(REEF)計畫」。我們鑑定性別化創新、生理性別和社會性別分析法,以及未來透過應用性別化創新研究方法的潛在「增值」點。
議題:
環境化學品(ECs)對人類生殖系統健康的潛在影響已對男性進行大量研究。一份專家小組對世界衛生組織(WHO)的報告指出,儘管「女性生殖系統發育也容易受到內分泌干擾」,但是「針對女性生殖系統健康的變化趨勢研究遠少於男性」(Damstra等人,2002)。
方法:設計健康與生物醫學研究
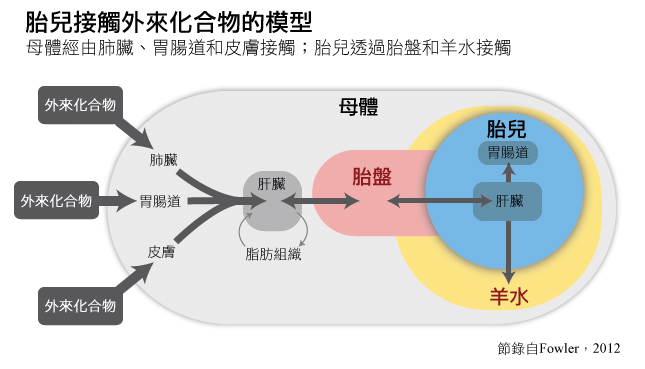
研究人員以設計實驗來彌補有關環境化學品對女性生殖系統健康之潛在影響的科學知識。在有控制組的對照實驗中採樣雌性動物可以創造接觸環境化學品後之生理和遺傳結果方面的新知識。研究人員也會採樣懷孕的雌性動物,並以妊娠結果做為實驗終點。此外,研究妊娠婦女可以讓研究人員特別調查子宮內接觸環境化學品對男女胎兒的影響,並說明其對化學品之敏感性的生理性別差異。
性別化創新:
-
環境化學品對女性生殖系統之影響計畫著重於探討懷孕婦女以及其女性和男性後代接觸環境化學物質後的影響。
-
環境化學品對女性生殖系統之影響計畫經由分析生理性別比較子宮內環境化學品對雌性以及雄性動物包括人類的影響。此外,產後的動物研究也有監測環境化學品於人體影響的潛在意義。
透過未來性別化創新研究法的應用增加未來研究的潛在價值
-
研究妊娠和環境化學品間可能的相互作用。
-
瞭解生理性別、年齡、職業、地理位置、社經地位、飲食和身體組成對環境化學品於人體的潛在影響。
背景:歐盟框架計畫七(FP7)及環境化學品對女性生殖系統之影響(REEF)計畫
性別化創新 1:研究環境化學品對懷孕婦女以及其後代的影響
方法:設計健康與生物醫學研究
性別化創新 2:比較環境化學品對雌性與雄性的影響
方法:分析生理性別
透過未來性別化創新研究法的應用增加未來研究的潛在價值
增值點 1:研究妊娠和環境化學品間可能的相互作用
增值點 2:瞭解性別、年齡、職業、地理位置、社經地位和身體組成對環境化學品於人體的潛在影響
方法:交織性研究方法
結論
參考資料
背景
「環境化學品對女性生殖系統之影響(REEF)計畫」主要研究環境化學品(ECs,包含內分泌干擾物)對哺乳動物之影響,具有透過辨認出環境化學品可能帶來的風險來改善人類健康之潛力。環境化學品對女性生殖系統之影響計畫研究人員「最終關注的是確定接觸環境化學品如何對人類女性胎兒發展造成影響(REEF, 2009b)。該計畫亦研究了男性胎兒(Fowler et al., 2008)。下圖顯示環境化學品對女性生殖系統之影響計畫實驗子集之間的關係:
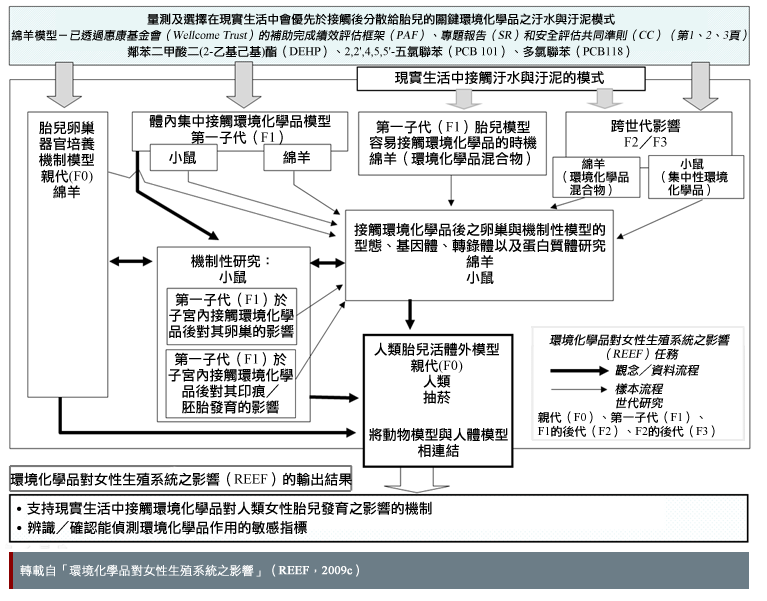
在「環境化學品混合物」實驗中,與環境相關之環境化學品劑量可透過放牧於汙水和汙泥處理過之牧地的綿羊群取得。這些動物因接觸過複雜的化學混合物,與實驗室只研究單一化學測試品相比,反而較能反映人類接觸的模式(NECTAR,
2009)。環境化學品的影響可能是加成性的,也就是說,同時接觸特定劑量的兩種或多種化學品可能會引起副作用,但是只接觸相同劑量之任何單一化學品則不會造成傷害。此外,環境化學品的影響效果可以是協同的,亦即同時接觸兩種或多種化學品的影響可能比只個別接觸單一種化學品的總加成效果更大(Kortenkamp et al., 2011; Crews et al., 2003)。
在本個案研究中,環境化學品的接觸包含刻意接觸(例如:吸菸)—見圖。
性別化創新 1:研究環境化學品對懷孕婦女以及其後代的影響
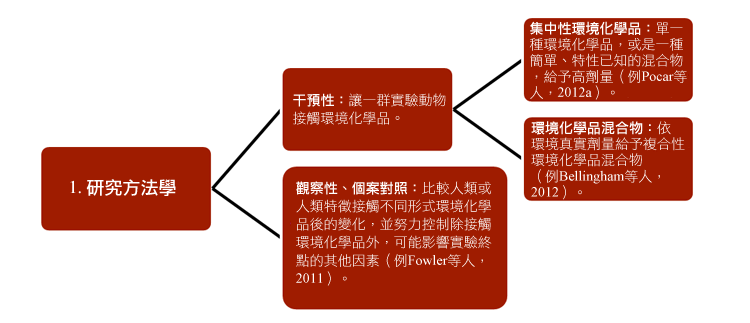
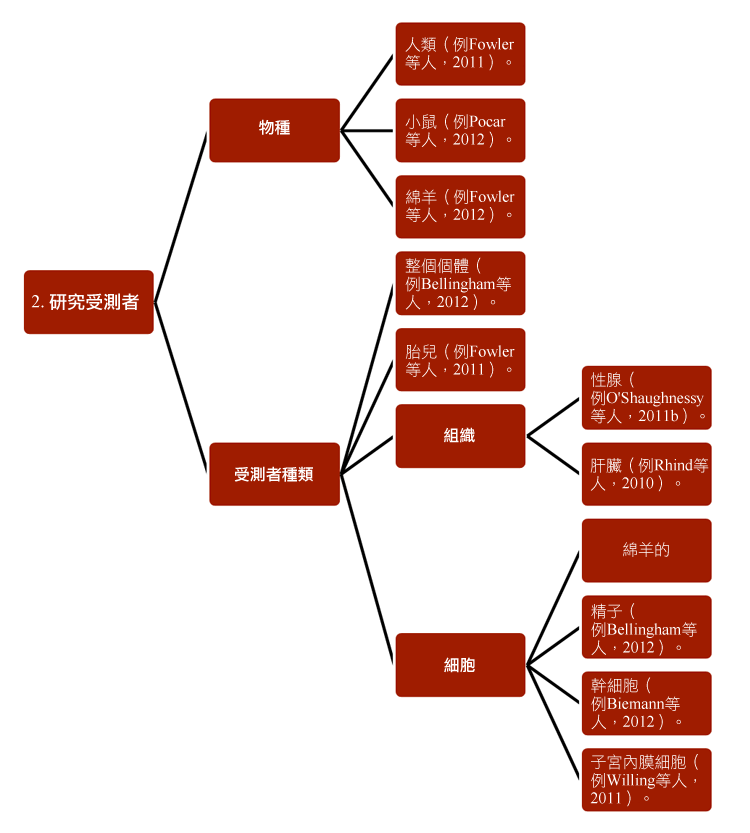
環境化學品對女性生殖系統之影響計畫已經發展出新的策略,以研究環境化學品對妊娠婦女及其後代的影響,且與環境監測及立法有關。研究人員結合各種已經建立的研究方法,包含:1) 方法學;2)研究受測者;3)生殖世代;4)接觸途徑和5)研究終點—見圖表。
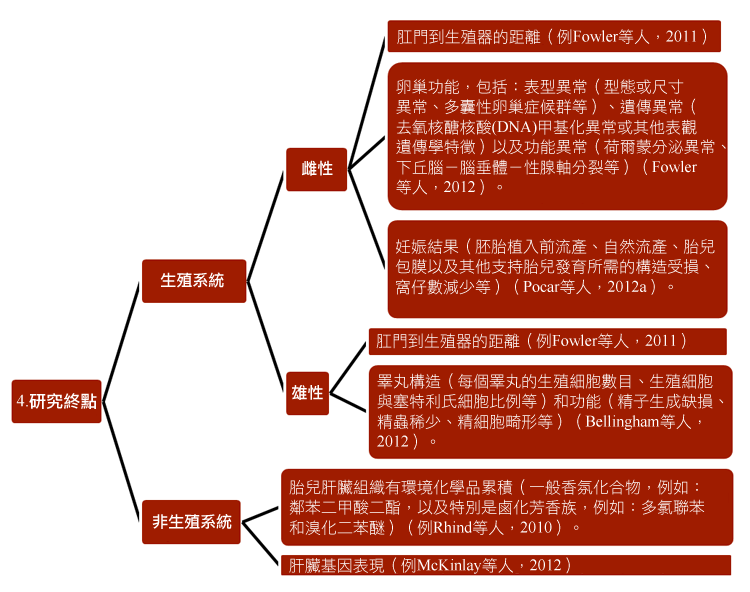

研究還特別增加妊娠反應,特別是子宮內膜組織的功能和表觀遺傳學的基礎知識(Sandra et al., 2010)。部分的研究結果已描述於「性別化創新 2」。
方法:設計健康與生物醫學研究
環境化學品對女性生殖系統之影響的研究人員利用綿羊、小鼠和人類設計實驗,並在每種動物模式中同時採樣雌性與雄性,以及比較懷孕和非懷孕雌性動物的差異(Pocar et al, 2012a; Pocar et al, 2012b)。這樣的實驗設計有助於檢測化學品接觸後,因特定生理性別而產生的結果(例如:雌性動物的卵巢閉鎖和雄性動物的精子品質低劣)。甚而,這種實驗設計也有助於辨識或排除環境化學品之影響中的生理性別差異。
性別化創新 2:比較環境化學品對雌性與雄性的影響
環境化學品對女性生殖系統之影響的研究人員已經確定環境化學品對雄性和雌性動物之影響的相似性和差異性。這些異同包括:
-
生理性別相似性和差異性對環境化學品於骨骼恆定的影響:母羊和公羊若於受環境化學品汙染的牧地(使用受汙染的汙水和汙泥施肥)放牧,兩者皆有相似的骨骼缺損問題,只是「公羊的骨骼組織對受物染的汙水和汙泥比母羊的骨骼組織敏感」。其中相較於母羊,公羊的骨質密度會增加,骨骼橫切面積會下降,而且骨髓腔的空隙也會縮小(Lind et al., 2009)。
-
生理性別差異對環境化學品代際傳遞的影響:懷孕小鼠接觸特定濃度的多氯聯苯(PCBs)後,他們的後代將顯示不同性別的發育缺陷,像是雌性小鼠專有的卵泡閉鎖和雄性小鼠才有的精子活力不足。然而,這些現象的遺傳能力稍有不同:雌性小鼠後代只有第一代會受到影響,但是雄性小鼠後代一直到第三代都還會受到影響(Pocar et al., 2012b)。在此實驗中,妊娠雌性小鼠會被餵食高達100 微克/公斤/天的多氯聯苯同系混合物(PCB101和PCB108)。這兩種同系物具有的毒性當量因子(TEFs)為0.00003 (U.S. EPA, 2009; Van den Berg et al., 2005)。因此,此接觸量等同於0.03微克毒性當量(TEQ)/公斤/天或是30,000皮克毒性當量(TEQ)/公斤/天,遠比一般人類攝取量(估計為1皮克毒性當量(TEQ)/公斤/天)高出許多(Judd et al., 2004)。
-
生理性別相似性和差異性對環境化學品於人類胎兒肝臟發展的潛在影響:研究人員檢查胎兒肝臟細胞信使核醣核酸 (mRNA) 的轉錄程度和蛋白質的表現發現,胎兒肝臟細胞酵素於吸菸或非吸菸組母親間的表現的確不同。在某些情況下,同一吸菸組內兩種性別所觀察到的結果相同,而且相較於非吸菸組皆有較高濃度的EPHX1酵素表現。在其他情況下,兩種性別間所觀察到的結果則不相同,也就是說,吸菸組內的男性胎兒肝臟細胞之GGT1、CYP2R1和CAR酵素的表現皆被抑制,而這些酵素於吸菸組內的女性胎兒肝臟細胞卻沒有被抑制的現象(O'Shaughnessy et al., 2011a)—見圖。
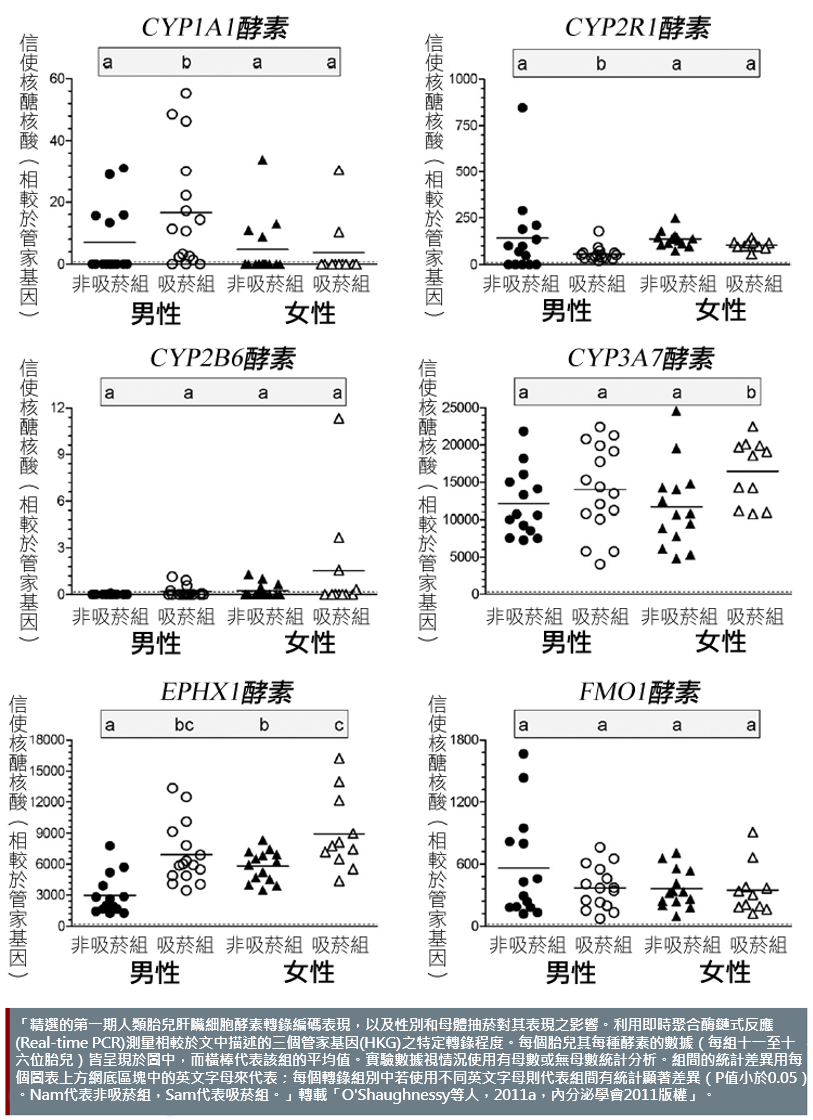
方法:分析生理性別
透過研究兩種生理性別的動物,研究人員發現環境化學品對兩種生理性別影響的相似與差異性(Pocar et al., 2012a; Lind et al., 2009)。許多環境化學品對女性生殖系統之影響的研究在特定的實驗中使用兩種生理性別的動物模型,以避免因利用單一生理性別研究的整合分析結果而造成生理性別差異評估的困難(Fowler et al., 2011; O'Shaughnessy et al., 2011a)。
透過未來性別化創新研究法的應用增加未來研究的潛在價值
增值點 1:研究妊娠和環境化學品間可能的相互作用
研究人員可以透過分析與生理性別相互作用的因素來獲得更多知識。對女性而言,妊娠可能是接觸環境化學品及其後果的重要決定因素。許多環境化學品對女性生殖系統之影響的研究已比較雄性動物和非懷孕雌性動物間的差異,而其他研究也仔細調查過懷孕雌性動物模式,但是沒有專門比較懷孕和非懷孕雌性動物間差異的研究。這類比較可能可以提供關於環境化學品於妊娠期間之吸收、流通和代謝的資訊。
增值點 2:瞭解生理性別、年齡、職業、地理位置、社經地位和身體組成對環境化學品於人體的潛在影響
若將環境化學品對女性生殖系統之影響的計畫擴大並涵蓋人類群體的流行病學研究,許多除了生理性別以外的變數將會是瞭解環境化學品接觸和其後果的重要因素。
方法:交織性研究方法
需要考慮的變數包括:
接觸年齡:
成人主要經食物接觸環境化學品,而孩童則可能因吮指而吸收這類物質(Sexton et al., 2004)。空氣傳播的環境化學品(例如氣體、噴霧劑以及微粒物質)濃度傾向集中靠近地面,因此孩童偏矮的身高可能會增加他們吸入環境化學品的風險(Moya et al., 2004)。年齡會影響環境化學品的接觸後果以及形式。環境化學品可能對發育中的胎兒、嬰幼兒、青春期前的孩童和成人造成不同程度的影響(Barker, 2004)。 年齡可能與生理性別相互影響。舉例來說,透過飲用水接觸到無機砷的人當中,與男性相比,女性可以顯著並有效地將具有高毒性的無機砷代謝成低毒性的二甲基胂化合物。此生理性別差異結果受年齡影響,女性的代謝優勢在停經後即消失(Lindberg et al., 2008)。- 職業:農業社會中依社會性別劃分的勞動力會影響接觸的環境化學品種類。在機械農作的地區,例如美國和歐洲,主要的農作人員皆為男性(U.S. Department of Labor Employment and Training Association, 2010; NationMaster Labor Statistics, 2010)。在這些國家中,因職業需要而接觸農藥的多數為男性(Rusiecki et al., 2004)。相反地,在非洲百分之七十五的農作人員為女性(London et al., 2002; NationMaster Labor Statistics, 2010)。性別不平等也產生其他問題,例如:開發中國家的女性教育程度普遍較男性低,因此不太能看懂農藥標籤上的警示。在許多國家中,女性也不太可能比男性有機會取得防護裝備,例如:手套和口罩等(London et al., 2002)。 社會性別角色會同時影響有償和無償勞動的模式,例如家事勞動會影響接觸環境化學品的風險(Snijder et al., 2012)。最近研究顯示,在美國女性承擔了百分之六十五至七十五的居家清潔工作(Coltrane, 2000)。居家清潔工作是接觸壬基酚【Nonylphenol […]及其聚氧乙烯醚(ethoxylates)普遍作為工業和家事清潔劑的表面活性劑】的潛在來源(Wilson et al., 2007)。然而,已有研究證實尿液中的壬基酚濃度並無顯著生理性別差異(Calafat et al., 2005)。
- 社經地位:社經地位的衡量(例如家庭收入)在某些個案中與環境化學品的接觸量有關。舉例來說,美國居民中家庭收入愈高,其尿液的三氯沙【triclosan,一種有廣泛殺菌活性的合成化學品,普遍存在於消費性產品(包括個人護理產品、織品和塑膠廚具)中】濃度愈高(Calafat et al., 2008a)。另一種環境化學品,塑化劑雙酚A(Bisphenol A)和辛基酚(4-tertiary-Octylphenol)則呈現相反模式,也就是低收入族群的尿液中這類化學品的濃度反而最高(Calafat et al., 2008b)。低社經地位可能會增加汙染物的接觸機會。以美國為例,低收入族群可能不成比例地居住於有高濃度汙染物的不受歡迎區域,例如:有垃圾焚化爐圍繞的區域(Mohai et al., 2009)。英國的研究人員調查特定區域環境汙染物與居民社經地位間的關係發現其中涉及的關聯性相當複雜,而且觀察到的趨勢容易同時受到汙染物和健康量測方式的影響(Briggs et al., 2008)。
- 地理位置:地理位置會決定接觸的環境化學品種類。舉例來說,住在農業區的人即使本身不是農作人員也可能透過空氣接觸噴灑的農藥(Ward et al., 2000)。
- 身體組成:在美國,身體質量指數(BMI)較高的成人其尿液的雙酚A(BPA)濃度較其他身體質量指數較低的成人顯著偏高,而且雙酚A的濃度與身體質量指數有很大程度的相關性(Lang et al., 2008)。雖然已知接觸雙酚A會導致動物模型肥胖,肥胖的人體內的雙酚A濃度也因為累積一些親脂性化合物(例如許多環境化學品)而偏高(Vandenberg et al., 2007)。
結論
由於子宮環境的特殊特性以及胎兒在接觸特定形式環境化學品後的敏感性,若缺乏妊娠和胎兒發育研究,將無法充分瞭解環境化學品對兩性的影響。對於研究環境化學品對女性生殖系統之影響的人員而言,其主要目標是「將小鼠和綿羊在接觸[…]後的研究結果與人類的研究互相整合」(REEF, 2009b)。這類整合除需要考慮一些社會因素(例如:社會性別角色以及社經地位)外,也需要考慮生物因素(例如:年齡、生理性別以及身體組成)。
參考文獻
Bakker, R. (2011). Maternal Lifestyle and Pregnancy Complications: The Generation R Study. Rotterdam: Optima Grafische Communicatie.
Barker, D. (2004). The Developmental Origins of Adult Disease. Journal of the American College of Nutrition, 23 (S6), 588S-595S.
Barbeau, E., Krieger, N., & Soobader, M. (2004). Working Class Matters: Socioeconomic Disadvantage, Race/Ethnicity, Gender, and Smoking in the National Health Information Survey (NHIS) 2000. American Journal of Public Health, 94 (2), 269-278.
Bautier, P. (2006). International Women's Day: A Statistical View of the Life of Women and Men in the EU25. Luxembourg: Eurostat Press Office
Bellingham, M., McKinnell, C., Fowler, P., Amezaga, M., Zhang, Z., Rhind, M., Cotinot, C., Mandon-Pepin, B., Evans, N., & Sharpe, R. (2012). Foetal and Post-Natal Exposure of Sheep to Sewage Sludge Chemicals Disrupts Sperm Production in Adulthood in a Subset of Animals. International Journal of Andrology, (epub ahead of print).
Biemann, R., Santos, A., Santos, A., Riemann, D., Knelangen, J., Blüher, M., Koch, H., & Fischer, B. (2012). Endocrine Disrupting Chemicals Affect the Adipogenic Differentiation of Mesenchymal Stem Cells in Distinct Ontogenetic Windows. Biochemical and Biophysical Research Communications, 417 (2), 747-752.
Boyle, P., & Ferlay, J. (2004). Cancer Incidence and Mortality in Europe, 2004. Annals of Oncology, 16 (3), 481-488.
Briggs, D., Abellan, J., & Fecht, D. (2008). Environmental Inequality in England: Small Area Associations between Socio-Economic Status and Environmental Pollution. Social Science in Medicine, 67 (10), 1612-1629.
Calafat, A., Ye, X., Wong, L., Reidy, J., & Needham, L. (2008a). Urinary Concentrations of Triclosan in the U.S. Population: 2003-2004. Environmental Health Perspectives, 116 (3), 303-307.
Calafat, A., Ye, X., Wong, L., Reidy, J., & Needham, L. (2008b). Exposure of the U.S. Population to Bisphenol A and 4-tertiary-Octylphenol: 2003–2004. Environmental Health Perspectives, 116 (1), 39-44.
Calafat, A., Wong, L., Kuklenyik, Z., Reidy, J., & Needham, L. (2007). Polyfluoroalkyl Chemicals in the U.S. Population: Data from the National Health and Nutrition Examination Survey (NHANES) 2003–2004 and Comparisons with NHANES 1999–2000. Environmental Health Perspectives, 115 (11), 1596-1602.
Calafat, A., Kuklenyik, Z., Reidy, J., Caudil, S., Ekong, J., & Needham, L. (2005). Urinary Concentrations of Bisphenol A and 4-Nonylphenol in a Human Reference Population. Environmental Health Perspectives, 113 (4), 391-395.
Coltrane, S. (2000). Research on Household Labor: Modeling and Measuring the Social Embeddedness of Routine Family Work. Journal of Marriage and Family, 62 (4), 1208-1233.
Crews, D., Putz, O., Thomas, P., Hayes, T., & Howdeshell, K. (2003). Wildlife as Models for the Study of how Mixtures, Low Doses, and the Embryonic Environment Modulate the Action of Endocrine-Disrupting Chemicals. Pure and Applied Chemistry, 75 (11-12), 2305-2320.
Damstra, T., Barlow, S., Bergman, A., Kavlock, R., & Van der Kraak, G. (2002). Global Assessment of the State-of-the-Science of Endocrine Disruptors. Geneva: World Health Organization (WHO).
Ferlay, J., Autier, P., Boniol, M., Heanue, M., Colombet, M., & Boyle, P. (2006). Estimates of the Cancer Incidence and Mortality in Europe in 2006. Annals of Oncology, 18 (3), 581-592.
Fowler, P., Bellingham, M., Sinclair, K., Evans, N., Pocar, P., Fischer, B., Schaedlich, K., Schmidt, J., Amezaga, M., Bhattacharya, S., Rhind, S., & O’Shaughnessy, P. (2012). Impact of Endocrine-Disrupting Compounds (EDCs) on Female Reproductive Health. Molecular and Cellular Endocrinology, 355 (2), 231-239.
Fowler, P. (2012). REEF (Reproductive Effects of Environmental Chemicals in Females): Presentation at the Gendered Innovations Expert's Meeting, May 18th-19th, Centro Nacional de Investigaciones Oncológicas (CNIO), Madrid.
Fowler, P., Bhattacharya, S., Flannigan, S., Drake, A., & O'Shaughnessy, P. (2011). Maternal Cigarette Smoking and Effects on Androgen Action in Male Offspring: Unexpected Effects on Second-Trimester Anogenital Distance. Journal of Clinical Endocrinology and Metabolism, 96 (9), E1502-E1506.
Fowler, P., Cassie, S., Rhind, S., Brewer, M., Collinson, J., Lea, R., Baker, P., Bhattacharya, S., & O'Shaughnessy, P. (2008). Maternal Smoking during Pregnancy Specifically Reduces Human Fetal Desert Hedgehog Gene Expression during Testis Development. Journal of Clinical Endocrinology and Metabolism, 93 (2), 619-626.
Judd, N., Griffith, W., & Faustman, E. (2004). Contribution of PCB Exposure from Fish Consumption to Total Dioxin-Like Dietary Exposure. Regulatory Toxicology and Pharmacology, 40 (2), 125-135.
Karim-Kos, H., de Vries, E., Soerjomataram, I., Lemmens, V., Siesling, S., Willem, J., & Coebergh, W. (2008). Recent Trends of Cancer in Europe: A Combined Approach of Incidence, Survival, and Mortality for 17 Cancer Sites since the 1990s. European Journal of Cancer, 44 (10), 1345-1389.
Katalinic, A., & Rawal, R. (2007). Decline in Brease Cancer Incidence after Decrease in Utilization of Hormone Replacement Therapy. Breast Cancer Research and Treatment, 107 (3), 427-430.
Kortenkamp, A., Martin, O., Faust, M., Evans, R., McKinlay, R., Orton, F., & Rosivatz, E. (2011). State of the Art Assessment of Endocrine Disrupters: Final Report. Brussels: European Commission.
Lang, I., Galloway, T., Scarlett, A., Henley, W., Depledge, M., Wallace, R., Mezler, D. (2008). Association of Urinary Bisphenol A Concentration with Medical Disorders and Laboratory Abnormalities in Adults. Journal of the American Medical Association, 300 (11), 1303-1310.
Lindberg, A., Ekström, E., Nermell, B., Rahman, M., Lönnerdal, B., Persson, L., & Vahter, M. (2008). Gender and Age Differences in the Metabolism of Inorganic Arsenic in a Highly Exposed Population in Bangladesh. Environmental Research, 106 (1), 110-120.
Lind, P., Gustafsson, M., Hermsen, S., Larsson, S., Kyle, C., Orberg, J., & Rhind, S. (2009). Exposure to Pastures Fertilized with Sewage Sludge Disrupts Bone Tissue Homeostasis in Sheep. Science of the Total Environment, 407 (7), 2200-2208.
London, L., de Grosbois, S., Wesseling, C., Kisting, S., Rother, H., & Mergler, D. (2002). Pesticide Usage and Health Consequences for Women in Developing Countries: Out Of Sight, Out Of Mind? International Journal of Occupational Health, 8 (1), 46-59.
Luebker, D., York, R., Hansen, K., Moore, J., & Butenhoff, J. (2005). Neonatal Mortality from in utero Exposure to Perfluorooctanesulfonate (PFOS) in Sprague–Dawley rats: Dose–Response, and Biochemical and Pharamacokinetic Parameters. Toxicology, 215 (1-2), 149-169.
McKinlay, R., O'Shaughnessy, P., Sharpe, R., & Fowler, P. (2012). In-Utero Exposure to Environmental Chemicals: Lessons from Maternal Cigarette Smoking and its Effects on Gonad Development and Puberty. In Diamantia-Kandarakis, E., & Gore, A. (Eds.), Endocrine Disruptors and Puberty, pp. 11-48. London: Humana Press.
Mohai, P., Pellow, D., & Roberts, J. (2009). Environmental Justice. Environment and Resources, 34, 405-130.
Moya, J., Bearer, C., & Etzel, R. (2004). Children’s Behavior and Physiology and How it Affects Exposure to Environmental Contaminants. Pediatrics, 113 (S3), 996-1006.
NationMaster Labor Statistics. (2010). Labor Statistics By Country, Agricultural Workers, Percent Female, Most Recent. Rapid Intelligence Online.
Network for Environmental Chemical Toxicants Affecting Reproduction (NECTAR). (2010). About.
Network for Environmental Chemical Toxicants Affecting Reproduction (NECTAR). (2009). NECTAR Cluster.
O'Shaughnessy, P., Monteiro, A., Bhattacharya, S., & Fowler, P. (2011a). Maternal Smoking and Fetal Sex Significantly Affect Metabolic Enzyme Expression in the Human Fetal Liver. Journal of Clinical Endocrinology and Metabolism, 96 (9), 2851-2860.
O'Shaughnessy, P., Monteiro, A., & Fowler, P. (2011b). Identification of Stable Endogenous Reference Genes for Real-Time PCR in the Human Fetal Gonad using an External Standard Technique. Molecular Human Reproduction, 17 (10), 620-625.
O'Shaughnessy, P., Monteiro, A., Bhattacharya, S., & Fowler, P. (2011a). Supplemental Data (Supplemental Table 1 and Supplemental Figures 1-2) — Maternal Smoking and Fetal Sex Significantly Affect Metabolic Enzyme Expression in the Human Fetal Liver. Journal of Clinical Endocrinology and Metabolism, 96 (9), 2851-2860.
Pocar, P., Fiandanese, N., Secchi, C., Berrini, A., Fischer, B., Schmidt, J., Schaedlich, K., & Borromeo, V. (2012a). Exposure to Di (2-Ethyl-Hexyl) Phthalate (DEHP) in Utero and During Lactation Causes Long-Term Pituitary-Gonadal Axis Disruption in Male and Female Mouse Offspring. Endocrinology, 153 (2), 937-948.
Pocar, P., Fiandanese, N., Secchi, C., Berrini, A., Fischer, B., Schmidt, J., Schaedlich, K., Rhind, S., Zhang, Z., & Borromeo, V. (2012b). Effects of Polychlorinated Biphenyls in Cd-1 Mice: Reproductive Toxicity and Intergenerational Transmission. Toxicological Sciences, 126 (1), 213-226.
Reproductive Effects of Environmental Chemicals in Females (REEF) Project. (2009a). Summary.
Reproductive Effects of Environmental Chemicals in Females (REEF) Project. (2009b). Objectives.
Reproductive Effects of Environmental Chemicals in Females (REEF) Project. (2009c). Program Evaluation Review Technique (PERT) Diagram.
Rhind, S., Kyle, C., Mackie, C., McDonald, L., Zhang, Z., Duff, E., Bellingham, M., Amezaga, M., Mandon-Pepin, B., Loup, B., Cotinot, C., Evans, N., Sharpe, R., & Fowler, P. (2010). Maternal and Fetal Tissue Accumulation of Selected Endocrine-Disrupting Compounds (EDCs) Following Exposure to Sewage Sludge-Treated Pastures Before or After Conception. Journal of Environmental Monitoring, 12 (8), 1582-1593.
Rhind, S., Kyle, C., Mackie, C., & McDonald, L. (2009). Accumulation of Endocrine Disrupting Compounds in Sheep Fetal and Maternal Liver Tissue following Exposure to Pastures Treated with Sewage Sludge. Journal of Environmental Monitoring, 11 (8), 1469-1476.
Rusiecki, J., De Roos, A., Lee, W., Dosemeci, M., Lubin, J., Hoppin, J., Blair, A., & Alavanja, M. (2004). Cancer Incidence among Pesticide Applicators Exposed to Atrazine in the Agricultural Health Study. Journal of the National Cancer Institute, 96 (18), 1375-1382.
Sandra, O., Mansouri-Attia, N., & Lea, R. (2010). Novel Aspects of Endometrial Function: A Biological Sensor of Embryo Quality and Driver of Pregnancy Success. Reproduction, Fertility, and Development, 24 (1), 68-79.
Schadt, E., Molony, C., Chudin, E., Hao, K., Yang, X., Lum, P., Kasarskis, A., Zhang, B., Wang, S., Suver, C., Zhu, J., Millstein, J., Sieberts, S., Lamb, J., Guha-Thakurta, D., Derry, J., Storey, J., Avila-Campillo, I., Kruger, M., Johnson, J., Rohl, C., van Nas, A., Mehrabian, M., Drake, T., Lusis, A., Smith, R., Guengerich, F., Strom, S., Schuetz, E., Rushmore, T., & Ulrich, U. (2008). Mapping the Genetic Architecture of Gene Expression in Human Liver. Public Library of Science (PLoS) Biology, 6 (5), e107.
Sexton, K., Needham, L., & Pirkle, J. (2004). Human Biomonitoring of Environmental Chemicals. American Scientist, 92 (1), 38-45.
Snijder, C., Roeleveld, N., Te Velde, E., Steegers, E., Raat, H., Hofman, A., Jaddoe, V., & Burdorf, A. (2012). Occupational Exposure to Chemicals and Fetal Growth: The Generation R Study. Human Reproduction, 27 (3), 910-920.
Soerjomataram, I., Pukkala, E., Brenner, H., Willem, J., & Coebergh, W. (2008). On the Avoidability of Breast Cancer in Industrialized Societies: Older Mean Age at First Birth as an Indicator of Excess Breast Cancer Risk. Breast Cancer Research and Treatment, 111 (2), 297-302.
United States Department of Labor Employment and Training Administration (ETA). (2010). The National Agricultural Worker's Survey. Washington, D.C.: Government Publishing Office (GPO).
United States Environmental Protection Agency (U.S. EPA). (2009). Recommended Toxicity Equivalency Factors (TEFs) for Human Health Risk Assessments of Dioxin and Dioxin-Like Compounds: External Review Draft. Washington, D.C.: Government Publishing Office (GPO).
Vandenberg, L., Hauser, R., Marcus, M., Olea, N., & Welshons, W. (2007). Human Exposure to Bisphenol A (BPA). Reproductive Toxicology, 24 (2), 139-177.
Van den Berg, M., Birnbaum, L., Denison, M., De Vito, M., Farland, W., Feeley, M., Fiedler, H., Hakansson, H., Hanberg, A., Haws, L., Rose, M., Safe, S., Schrenk, D., Tohyama, C., Tritscher, A., Tuomisto, J., Tysklind, M., Walker, N., & Peterson, E. (2006). The 2005 World Health Organization Reevaluation of Human and Mammalian Toxic Equivalency Factors for Dioxins and Dioxin-Like Compounds. Toxicological Sciences, 93 (2), 223-241.
Ward, M., Nuckols, J., Weigel, S., Maxwell, S., Cantor, K., & Miller, R. (2000). Identifying Populations Potentially Exposed to Agricultural Pesticides using Remote Sensing and a Geographic Information System. Environmental Health Perspectives, 108 (1), 5-12.
Willing, C., Peich, M., Danescu, A., Kehelen, A., Fowler, P., & Hombach-Klonisch, S. (2011). Estrogen-Independent Actions of Environmentally Relevant AhR-Agonists in Human Endometrial Epithelial Cells. Molecular Human Reproduction, 17 (2), 115-126.
Wilson, N., Chuang, J., Morgan, M., Lordo, R., & Sheldon, L. (2007). An Observational Study of the Potential Exposures of Preschool Children to Pentachlorophenol, Bisphenol-A, and Nonylphenol at Home and Daycare. Environmental Research, 103 (1), 9-20.
歐盟委員會要求以性別化創新研究計畫分析其框架計畫七(FP7)中的數個子計畫。環境化學品對女性生殖系統之影響計畫(REEF)旨在研究環境化學品(包含內分泌干擾物)對人類胎兒發育的影響。我們鑑定性別化創新、生理性別和社會性別分析法,以及未來透過應用性別化創新研究方法的潛在「增值」點。
性別化創新:
環境化學品對女性生殖系統之影響的研究同時採樣雌性與雄性動物,也同時採樣懷孕和非懷孕雌性動物,以檢測接觸環境化學品後因特定生理性別而產生的效果(例如:雌性動物的卵巢閉鎖和雄性動物的精子品質低劣),並辨識或排除生理性別差異。舉例來說,本研究設計使得環境化學品對女性生殖系統之影響的研究人員確定環境化學品對雄性綿羊的骨質健康(與雌性綿羊相比)有更多的負面影響。
透過未來性別化創新研究法的應用增加未來研究的潛在價值:
研究人員可以透過分析與生理性別交織的因子獲得更多知識。對女性而言,妊娠可能是接觸環境化學品及其後果的重要決定因素。許多環境化學品對女性生殖系統之影響的研究已比較雄性動物和非懷孕雌性動物間的差異,而其他研究也仔細調查過懷孕雌性動物模式,但是沒有專門比較懷孕和非懷孕雌性動物間差異的研究。這類比較可能可以提供關於環境化學品於妊娠期間之吸收、流通和代謝的資訊。
