海洋科學:
分析生理性別
議題
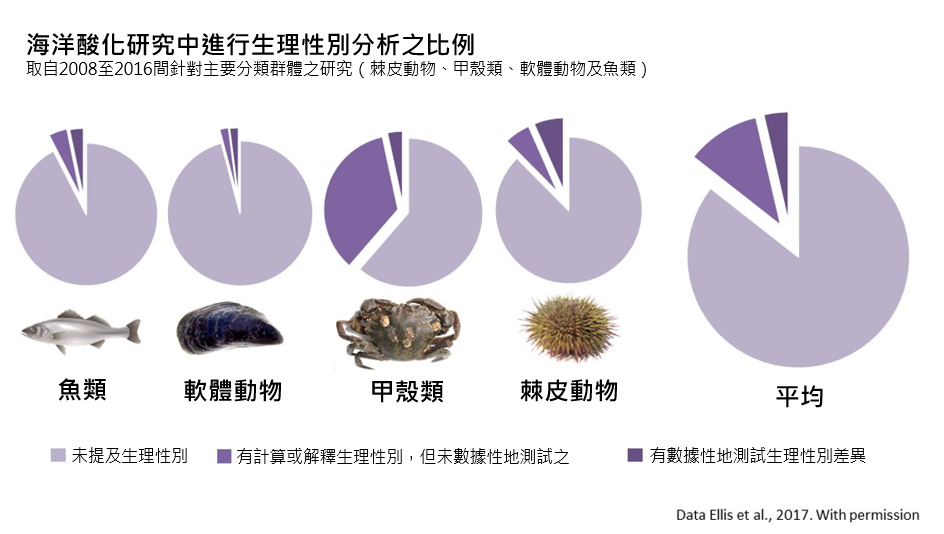
在海洋科學中,生理性別分析有很大程度是被忽視的(Tannenbaum et al., 2019)。例如,最近針對海洋酸化文獻的系統性審查顯示,只有3.7%的近期研究檢測了生理性別差異,85% 的研究根本沒有考慮到生理性別(Ellis et al., 2017)。未能考慮到這些差異將會影響我們有效管理生態系統以及設定保育之優先順序的能力。
方法:重新思考概念與理論
將生理性別納入海洋科學需要挑戰普遍存在的觀念,即「在環境干擾帶來的生物反應上,生理性別是無關緊要的」。我們還必須超越生理性別是二元的、固定的和基因決定的假設。自然界中充滿了連續體的生理性別、不穩定的生理性別,以及由遺傳、激素、生理、社會和/或環境過程的相互作用下而決定生理性別的例子。為了理解生理性別對基礎生物學的重要,思考生理性別的決定和分化之機制、時間點和方向,以及雌性、雄性和雌雄同體對環境擾動的反應差異是很重要的。
方法:分析生理性別
按生理性別分類和分析資料的研究點出了考量雌性和雄性對於氣候變遷之反應的重要。在許多海洋生物中,生理性別並不容易看出來。現在需要的便是在非模式生物中,進行新的、非侵入性的生理性別分析方法,這一努力將藉由日漸得以負擔之「體學」方法來促成。
性別化創新:
- 了解暖化海洋中的雌性化對解釋氣候變遷對於生理性別是因溫度而決定的動物(例如海龜)所構成的威脅是相當關鍵的。了解此類現象對於評估未來氣候變遷情景下的滅絕風險至關重要。
- 了解溫度以外的環境性別決定對於未來氣候變遷情景下,之於人類具有經濟、生態和實驗重要性的許多生物之族群統計至關重要。
- 以生理性別分析進行有效的族群管理將使自然資源的持續而永續地開發成為可能。
- 了解雌性與雄性對氣候變遷的敏感度差異對於充分記錄環境變化對族群和生態系統的影響至關重要。
議題
人為引起的氣候變遷是最嚴重且最普遍的全球議題之一(Hoegh-Guldberg & Bruno, 2010; Diffenbaugh & Field, 2013)。為使負面後果最小化,建立並施行有效的生態系統管理至關重要(Hoegh-Guldberg & Bruno, 2010),而這又取決於對於生物體和生態系統面對環境變化的恢復力之深刻理解(O’Leary et al., 2017; Patricio et al., 2019)。而我們尚未充分了解這樣的恢復力依生理性別不同之差異程度。
族群內的生理性別比例(sex ratio)是面對環境干擾之恢復力的主要決定因素(Ospina-Alvarez & Piferrer, 2008)。生理性別比例有部分是受到雌性、雄性和雌雄同體對氣候變遷壓力因素各自不同的敏感度而驅動的。儘管如此,生理性別卻鮮少被視作實驗變量加以分析(Tannenbaum et al., 2019)。例如,最近對海洋酸化相關文獻的系統性審查顯示,近期的研究中只有3.77%檢測了基於生理性別之差異(見下圖),而有 85% 的研究根本沒有考慮到生理性別(Ellis et al., 2017)。這導致了評估海洋酸化對於特定生理性別影響的實驗性證據之缺乏,亦限制了我們準確評估海生族群對海水 pH 值下降的恢復力之能力。而在進行了測試的實驗中,面對pCO2 的升高,已有顯著的生理性別差異之相關紀錄(Ellis et al., 2017)。未能考慮到這些差異將會影響我們有效管理生態系統及決定保育之優先順序的能力。
方法:重新思考概念與理論
要將生理性別作為實驗變量的一個主要障礙在於,人們普遍認為生理性別對於解釋物種面對不斷變化的環境條件之反應並不重要。在許多情況中,這種看法源於缺乏傳統模式生物以外之生物的性別差異相關文獻,例如秀麗隱桿線蟲。要挑戰這種觀念,需要在學術研究的所有三大支柱,亦即政策、出版和教育上採取整合性的取徑 (Tannenbaum et al., 2019)。補助機構的政策可以推動非模式生物中基於生理性別之研究的增加。研究的增加及隨後的同儕審查文獻將為下一代實驗人員提供關鍵的例子,說明如何在相關研究領域成功實施可靠的生理性別和社會性別分析方法。
科學和社會中進一步廣泛被接受的假設為生理性別是二元的、由基因決定,並在受精時便已固定的。此規則的例外通常會被視為異常(Bachtrog et al., 2014)。然而,在自然界中,多元的性型態以及生理性別決定機制挑戰了這樣的常規,並反過來支持著生理性別作為連續體的理解(Ainsworth, 2015)。舉例而言,雌雄同體(同一個體中存在雄性和雌性配子)發生在94%的開花植物中(Renner & Ricklefs, 1995)和三分之一的非昆蟲動物物種中 (Jarne & Auld, 2006)。若雌雄同體為連續性的(一個體在其一生中從一種生理性別變成另一種——某些物種會轉變不只一次),生理性別便會被呈現為是一種不穩定的特徵(Munday et al., 2006)。即便雌性與雄性之性型態變得清晰、明確而固定,性別決定仍往往取決於遺傳、荷爾蒙、生理、社會和/或環境過程之間的相互作用。為了理解生理性別對基礎生物學的重要性,思考生理性別決定和分化的機制、時間點和方向,以及雌性、雄性和雌雄同體對環境擾動的反應差異是很重要的(Ellis et al., 2017; Tannenbaum et al., 2019)。
方法:分析生理性別
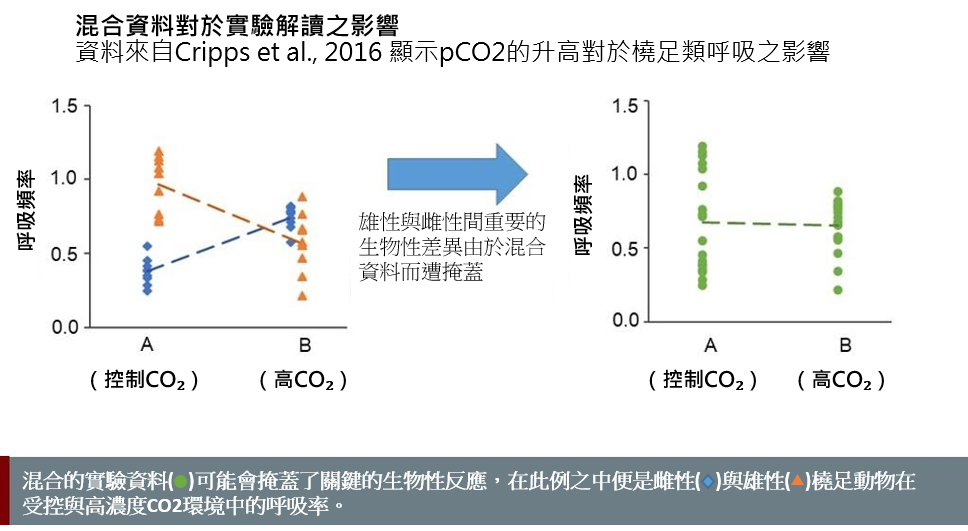
按生理性別分類的實驗結果能揭示生物學上的顯著差異。若將資料全混在一起,這些差異就會被掩蓋(見下圖)。然而,要做到這一點,需要準確的生理性別鑑定技術(可能的話採取非侵入性技術)。非模式海洋生物個體生理性別鑑定新方法的最新進展,包括基因(Benestan et al., 2017; Hines et al., 2007)、代謝體學(Ellis et al., 2014; Hines et al 2007)和內分泌技術(Jensen et al., 2018),皆顯著增強了我們準確預測氣候變遷對於部份群體之影響的能力。但是,將這些方法擴展到更廣泛的海洋生物群體的協同努力至關重要。這些努力將須透過不斷地創新和提升體學方法的可負擔性來推進。
性別化創新1:了解暖化海洋中的雌性化
海龜的「溫度決定生理性別」 (Temperature-dependent sex determination,TSD) 可能是自然界中研究最為廣泛且最著名的環境性別決定機制。然而,考量到氣溫升高僅利於其中一種生理性別的生成,從而破壞了族群生理性別比例的穩定,表現出 TSD 的物種因而被認為是最容易受到氣候變遷影響的物種(Mitchell & Janzen, 2010)。在海龜中,生理性別是由卵孵化期間的溫度決定。溫度越高,雌性比例越高(Hawkes et al., 2007; Hawkes et al., 2009; Patricio et al., 2019)。
依據孵化期間的溫度記錄作為族群統計的參考,已有研究基於未來的氣候暖化,預測了海龜高度雌性偏斜的族群生理性別比(e.g. Hawkes et al., 2007; Fuentes et al., 2011; Laloë et al., 2014)。然而,這種生理性別比例估計取決於生理性別決定中使用的參數,並且在使用不同參數時可能會有很大差異(Fuentes et al., 2011)。
結合腹腔鏡和內分泌技術的海龜生理性別鑑定之最新發展首次為近期的暖化對當代海龜種群的影響提供了經驗證據。強大的生理性別分析使研究人員能夠將雄性和雌性綠蠵龜與其出生的海灘進行連結,從而發現了(較溫暖的)北大堡礁族群已變得高度偏向雌性。來自北部地區的幼龜和亞成龜中有超過 99% 是雌性(相較於南部地區則有67%的雌性)(Jensen et al., 2018)。儘管海龜即使在高度偏向雌性的生理性別比例下,仍能維持其族群生存力,但北部綠蠵龜族群高達99.8% 的雌性亞成龜偏斜顯示了,北大堡礁族群完全雌性化並從而局部滅絕可能會在不久的將來發生(Jensen et al., 2018)。

性別化創新2:了解溫度以外的環境性別決定
生理性別決定機制落在從環境 (ESD) 到遺傳 (GSD) 的連續體上。現已在越來越多的物種中發現到,初級生理性別分化對於多樣的環境因素有反應。例如,缺氧會導致斑馬魚有較高的雄性比例(Shang et al., 2006)。相對地,海洋酸化導致在一個世代周期內,雌性牡蠣增加16% (Parker et al., 2018)。同樣地,水中pH值的提升會使雌性慈鯛魚增加(Oldfield, 2005)。而越來越明顯的是,生理性別比例的變化——無論是哪個方向——都會導致族群對於愈加劇烈之干擾的適應能力降低,並可能導致族群數量的崩跌。因此,對生理性別變化過程和其他具有生態意義之生理性別相關反應之機制的理解,對於在族群的層次上準確模擬人為干擾(例如過度捕撈或氣候變遷)的影響至關重要。
性別化創新3:生理性別分析強化有效的族群管理
準確了解族群結構可強化有效率的生態系統管理。次世代定序技術的最新發展促進了對各式的非模式物種族群結構變化之原因和後果的研究(Narum et al., 2013)。然而,有關海洋和蜉蝣(可耐海水和淡水)物種的研究中,只有 9.6%報告了生理性別資訊(Benestan et al., 2017)。
Benestan及其同事(2017)證明了在使用定序來解釋族群結構時理解生理性別比例的重要性。例如,在美國龍蝦中,這些作者展示了如果樣本的生理性別比例無意中存在偏差,兩個族群(近岸和離岸)會如何被誤解為兩個不同的亞種群。正確採樣的研究,例如留心收集了相同數量的雄性和雌性之研究,顯示實際上近岸和離岸美國龍蝦是個相關連的基因混合族群。在這種情況下,忽略生理性別資訊會導致對兩個不同族群的錯誤分類,進而可能導致效果不彰的管理建議。
美洲龍蝦是北美最有價值的漁獲。有效的族群管理已被證明可有效地將其永續開發最大化。例如,儘管氣候暖化,但在緬因州灣,以收穫為導向的主動保育之商業養殖仍取得了創紀錄的捕撈量 (Le Bris et al., 2018)。相反地,在缺乏此類管理的情況下,氣候的暖化導致了新英格蘭南部漁業的崩盤 (Le Bris et al., 2018)。
當保育工作存在生理性別偏誤時,準確的族群統計數據尤為重要。龍蝦保育工作保護了大型帶卵雌性(在腹部下方攜帶受精卵的雌性),但並不保護大型雄性。這種偏向雌性的保護導致選擇性地收穫大型雄性,從而限制交配的選擇與有限的精子,並降低了繁殖成功率(Tang et al., 2019)。面對氣候變遷,有效管理自然資源對於保持龍蝦族群的繁殖潛力變得相形重要。強大的生理性別分析將能確保對於族群結構知了解,從而準確地管理和保護。
性別化創新4:了解雌性與雄性對氣候變遷的敏感度差異
人為引起的氣候變遷導致海水溫度升高、海洋酸化、缺氧區和風暴事件。在測試中,生理性別分析已成為確定物種對於這些環境挑戰的反應之關鍵參數。例如,海水pCO2(溶解的二氧化碳)的升高會導致甲殼綱的兩性死亡率不同。雌性的蝦(Kurihara et al., 2008)和橈足類動物(Cripps et al., 2014)比起雄性而言都對氣候變化更加敏感。
然而這種模式並非總是成立,必須仔細分析。在橈足紡錘水蚤(Arcatia tonsa) 中,雌性就對高溫表現出更大的耐受度(Sasaki et al., 2019)。未考慮到因溫度升高而產生的生理性別差異,可能會忽略雄性對溫度有較高敏感度而造成精子量減少,因而低估此對族群數量的影響。
對於氣候變遷的反應之生理性別差異可能很複雜。Cripps及其同事(2016)最近以橈足類對pCO2上升的反應證明了這種複雜性。在正常情況下,雄性的基礎代謝率高於雌性。然而,為了應對 pCO2的升高,雌性的代謝率會升高而雄性則會降低 (Cripps et al., 2016)。在這種情況下,省略生理性別分析會掩蓋了生理表現中特定性別的反應,而這正是確定族群反應的基礎。
雌性和雄性生物體對不斷變化的環境條件的不同敏感度也會對實驗結果產生巨大、間接且通常是意想不到的影響。例如,在海洋橈足類動物中,環境條件會影響個體在水體中的聚集位置。研究顯示,不同的能量和繁殖需求會導致雌性主要聚集在含氧的水表層;雄性則聚集在氧氣濃度較低的深水中,因為牠們的位置主要受到溫度影響(Pierson et al., 2017)。如果這類的行為被忽視,研究人員僅從單一深度收集檢體樣本,便會無意中引入生理性別比例之偏差,從而產生不正確的實驗結論。
結論
在海洋和環境科學創新中納入生理性別分析將有助發現、研究效率、可重複性和穩健性。生理性別鑑定技術的最新發展將使生理性別分析更廣泛地被納入在這些學科中,且有助於海洋生物族群變化的模擬。這也將能提升我們有效管理生態系統和設定保育優先次序的能力。
下一步
為了推進海洋科學的生理性別分析並加強其在整個學科中的整合,我們建議:
- 補助機構和同儕審查期刊須發展在海洋科學以及更廣泛的生命科學領域要求生理性別分析的政策。
- 為越來越廣泛的非模式海洋生物開發新的生理性別鑑定技術,特別是形態上兩性異型不明顯的物種。
- 開發生理性別鑑定技術以改善其可近性、可靠性、成本和易用性。提高體學方法的可負擔性以及計算能力的進步都將有助其發展。
- 發展會在依生理性別報告結果時,將雌雄同體納入考量的研究(見雌雄同體物種的生理性別分析)。這將有助於模擬性別變化的時間點、方向和持續時間,以及性別決定機制。這項研究還應考慮個體對環境壓力的反應,其中不同生理性別的細胞/行為/生理機能須是同時共存的。
- 建立包含生理性別分析的生態系統功能和氣候變遷反應之模型。其中須提供足夠質量的生理性別分類資料。這樣的努力將能改進保育工作和海洋保護區的指定/管理,並能夠更完善地管理漁業。
參考資料
Ainsworth, C. (2015). Sex redefined. Nature News, 518(7539), 288.
Bachtrog, D., Mank, J. E., Peichel, C. L., Kirkpatrick, M., Otto, S. P., Ashman, T. L., …& Perrin, N. (2014). Sex determination: why so many ways of doing it? PLoS biology, 12(7). https://doi.org/10.1371/journal.pbio.1001899
Benestan, L., Moore, J. S., Sutherland, B. J., Le Luyer, J., Maaroufi, H., Rougeux, C., … & Tallman, R .F (2017). Sex matters in massive parallel sequencing: evidence for biases in genetic parameter estimation and investigation of sex determination systems. Molecular ecology, 26(24), 6767-6783.
Cripps, G., Lindeque, P., & Flynn, K. J. (2014). Have we been underestimating the effects of ocean acidification in zooplankton? Global Change Biology 20, 3377-3385.
Cripps, G., Flynn, K. J., & Lindeque, P. K. (2016). Ocean acidification affects the phyto-zoo plankton trophic transfer efficiency. PLoS One 11. https://doi.org/10.1371/journal.pone.0151739
Diffenbaugh, N. S., & Field, C. B. (2013). Changes in ecologically critical terrestrial climate conditions. Science, 341(6145), 486-492.
Ellis, R. P., Davison, W., Queirós, A. M., Kroeker, K. J., Calosi, P., Dupont, S., …. & Urbina, M.A. (2017). Does sex really matter? Explaining intraspecies variation in ocean acidification responses. Biology letters, 13(2). https://doi.org/10.1098/rsbl.2016.0761
Ellis, R. P., Spicer, J. I., Byrne, J. J., Sommer, U., Viant, M. R., White, D. A., & Widdicombe, S., 2014. 1H NMR metabolomics reveals contrasting response by male and female mussels exposed to reduced seawater pH, increased temperature, and a pathogen. Environmental science & technology, 48(12), 7044-7052.
Fuentes, M. M. P. B., Limpus, C. J., & Hamann, M. (2011). Vulnerability of sea turtle nesting grounds to climate change. Global Change Biology, 17(1), 140-153.
Hawkes, L. A., Broderick, A. C., Godfrey, M. H., & Godley, B. J. (2007). Investigating the potential impacts of climate change on a marine turtle population. Global Change Biology, 13(5), 923-932.
Hawkes, L. A., Broderick, A. C., Godfrey, M. H., & Godley, B. J. (2009). Climate change and marine turtles. Endangered Species Research, 7(2), 137-154.
Hines, A., Yeung, W. H., Craft, J., Brown, M., Kennedy, J., Bignell, J., …. & Viant, M. R. (2007). Comparison of histological, genetic, metabolomics, and lipid-based methods for sex determination in marine mussels. Analytical Biochemistry, 369(2), 175-186.
Hoegh-Guldberg, O., & Bruno, J. F. (2010). The impact of climate change on the world’s marine ecosystems. Science, 328(5985), 1523-1528.
Jensen, M. P., Allen, C. D., Eguchi, T., Bell, I. P., LaCasella, E. L., Hilton, W. A., …. & Dutton, P. H. (2018). Environmental warming and feminization of one of the largest sea turtle populations in the world. Current Biology, 28(1), 154-159.
Jarne, P., & Auld, J.R. (2006). Animals mix it up too: the distribution of self‐fertilization among hermaphroditic animals. Evolution, 60(9), 1816-1824.
Kurihara, H., Matsui, M., Furukawa, H., Hayashi, M., & Ishimatsu, A. (2008). Long-term effects of predicted future seawater CO2 conditions on the survival and growth of the marine shrimp Palaemon pacificus. Journal of Experimental Marine Biology and Ecology 367, 41-46.
Laloë, J. O., Cozens, J., Renom, B., Taxonera, A., & Hays, G. C. (2014). Effects of rising temperature on the viability of an important sea turtle rookery. Nature Climate Change, 4(6), 513.
Le Bris, A., Mills, K. E., Wahle, R. A., Chen, Y., Alexander, M. A., Allyn, A. J., …. & Pershing, A. J. (2018). Climate vulnerability and resilience in the most valuable North American fishery. Proceedings of the National Academy of Sciences, 115(8), 1831-1836.
Mitchell, N. J., & Janzen, F. J. (2010). Temperature-dependent sex determination and contemporary climate change. Sexual Development, 4(1-2), 129-140.
Munday, P. L., Buston, P. M., & Warner, R. R. (2006). Diversity and flexibility of sex-change strategies in animals. Trends in Ecology & Evolution, 21(2), 89-95.
Narum, S. R., Buerkle, C. A., Davey, J. W., Miller, M. R., & Hohenlohe, P. A. (2013). Genotyping‐by‐sequencing in ecological and conservation genomics. Molecular ecology, 22(11), 2841-2847.
Oldfield, R. G. (2005). Genetic, abiotic and social influences on sex differentiation and the evolution of sequential hermaphroditism. Fish & Fisheries. 6, 93-110.
O'Leary, J. K., Micheli, F., Airoldi, L., Boch, C., De Leo, G., Elahi, R., …. & Lummis, S. (2017). The resilience of marine ecosystems to climatic disturbances. BioScience, 67(3), 208-220.
Ospina-Alvarez, N., & Piferrer, F. (2008). Temperature-dependent sex determination in fish revisited: prevalence, a single sex ratio response pattern, and possible effects of climate change. PloS one, 3(7). https://doi.org/10.1371/journal.pone.0002837
Pierson, J. J., Slater, W. C. L., Elliott, D., & Roman, M. R. (2017). Synergistic effects of seasonal deoxygenation and temperature truncate copepod vertical migration and distribution. Marine Ecology Progress Series, 575, 57-68.
Renner, S. S., & Ricklefs, R. E. (1995). Dioecy and its correlates in the flowering plants. American Journal of Botany, 82(5), 596-606.
Parker, L. M., O'Connor, W. A., Byrne, M., Dove, M., Coleman, R. A., Pörtner, H. O., …. & Ross, P.M., 2018. Ocean acidification but not warming alters sex determination in the Sydney rock oyster, Saccostrea glomerata. Proceedings of the Royal Society B: Biological Sciences, 285(1872), p.20172869.
Patrício, A. R., Varela, M. R., Barbosa, C., Broderick, A. C., Catry, P., Hawkes, L. A., …. & Godley, B. J. (2019). Climate change resilience of a globally important sea turtle nesting population. Global change biology, 25(2), 522-535.
Sasaki, M., Hedberg, S., Richardson, K., & Dam, H. G. (2019). Complex interactions between local adaptation, phenotypic plasticity and sex affect vulnerability to warming in a widespread marine copepod. Royal Society Open Science, 6(3). https://doi.org/10.1098/rsos.182115
Shang, E. H., Yu, R. M., & Wu, R. S. (2006). Hypoxia affects sex differentiation and development, leading to a male-dominated population in zebrafish. Environmental Science & Technology, 40(9), 3118-3122.
Tang, F., Sainte-Marie, B., Gaudette, J., & Rochette, R. (2019). Role of gamete limitation in the occurrence of ‘abnormal early clutches’ on female American lobster, Homarus americanus, in eastern Canada. Marine Biology, 166(11), 146.
Tannenbaum, C., Ellis, R. P., Eyssel, F., Zou, J., & Schiebinger, L. (2019). Sex and gender analysis improves science and engineering. Nature, 575(7781), 137-146.