動物研究自始就對科學及醫學來說都致關重要。然而,直至1960年代,研究者都很少報告動物的生理性別,除非是與生殖相關的實驗。即使到了今日,動物的生理性別「在22-42%的神經科學、生理學及跨學科生物學期刊中是被忽略的」(Beery & Zucker, 2011)。在說明了生理性別的動物研究分析中顯示,除了生殖生物學與免疫學之外,雌性在大多數的子領域中都有代表性不足的狀況——詳見下圖。
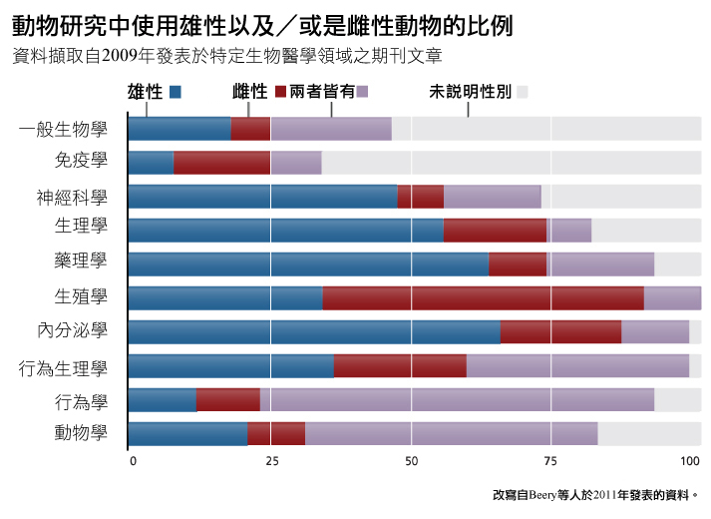
總論:雌性動物單一生理性別實驗的代表性不足,僅能出現在特定生理性別之現象(例如卵巢癌或前列腺癌),且儘鑽研某一生理性別是有效益的(McCarthy & Becker, 2002)。然而,大多數的單一生理性別動物實驗並不在此範圍之內。雌性動物在研究中的代表性不足常發生於對兩種生理性別皆有影響的情形,以及已有證據顯示生理性別會對結果產生影響之研究當中。
什麼時候可以只做單一性別實驗?
- 研究特定性別現象時,例如卵巢癌或前列腺癌。
- 為強調特定領域中,某一生理性別之已發表資料的不足時。
- 數據上有確切證據顯示生理性別不會影響特性或結果時。
在單一性別佔了多數的疾病中,例如乳癌,兩種生理性別或許仍皆需要被納入其中,但研究者可能會選擇不使用相同數量的性別個體。面對在女性和男性身上完全不同,但其動物模型的發展卻僅有單一性別之疾病時,情況又顯得更為複雜。舉例而言,高血壓的動物模型就未能準確地反映女性的心臟疾病生理學。針對這些情況,我們必須發展出新的模型。在女性身上就發現了不同的患病模式,冠狀動脈阻塞的情況較少,但由於微血管內皮作用的變化,而有較多微血管疾病(Ouyang, P. et al., 2016; Miller, V.M. et al., 2011; Mehta, L.S., 2016; Regensteiner, J., 2015)。冠狀微血管疾病的動物模型需要被建立,包括考量到孕期相關情形的潛在交互影響之動物模型,例如子癲前症或妊娠高血壓,以及與更年期神經血管束失調相關的「熱潮紅」,和新陳代謝相關問題如糖尿病等。
動物研究的生理性別與實驗室環境
- 要如何善加設計考量了生理性別(生物性特徵)與環境因素和過程的動物實驗呢?下圖呈現的是囓齒動物的完整生命週期中,生理性別與環境間複雜的交互作用,其中亦包括了研究人員生理性別。
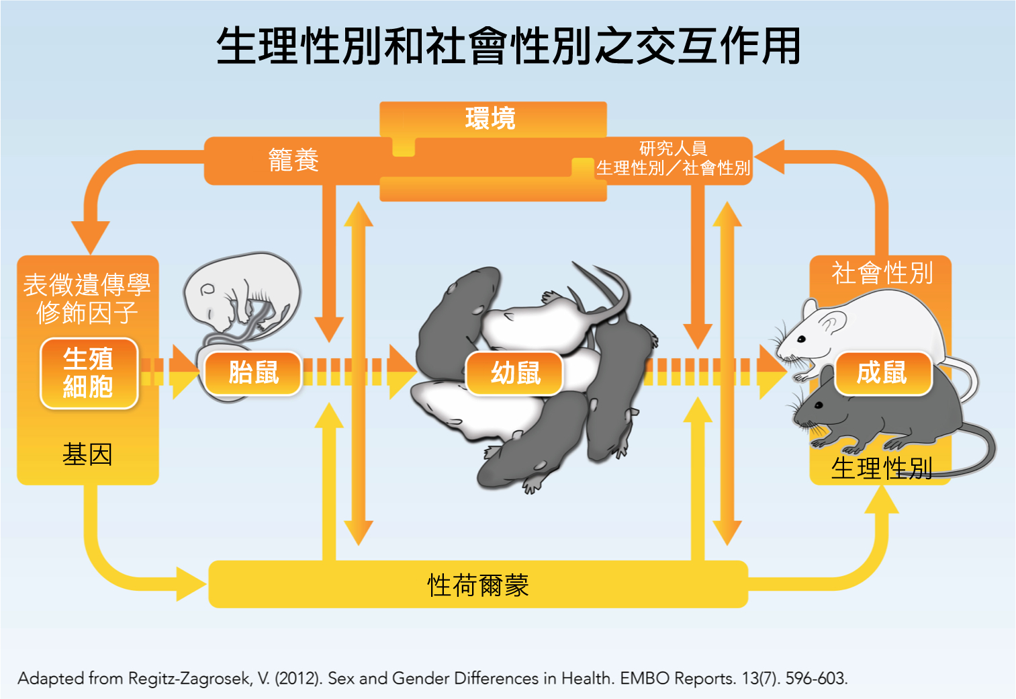
動物研究包含了生理性別(生物性特質,例如基因、荷爾蒙、年齡、繁殖週期、品系等等)以及環境狀況(例如籠養、研究人員之生理性別、研究人員之態度與行為、室溫、飲食等等)之間的交互作用。
研究設計
- 調查生理性別扮演的角色
- 必先查明生理性別的影響,才可將之屏除。
- 研究可採逐步方式進行。雌雄動物需要品系相應(或品系相應且基因型相應)並年齡相應,而且飼養在一致的環境(飼養籠、墊料、飲食等等)中。雌性動物不應在育兒狀態,除非需要此表型之相關評估。
- 第一步。樣本數(根據檢定力計算而定)。在研究中同時納入雌性與雄性通常需要加倍的受試對象,但並非總是如此。有效率的實驗設計可納入生理性別,並同時維持著對於變異數的掌握(Beery, 2018)。舉例而言,複因子設計只須增加14-33%的樣本數,無須倍增(Buch et al., 2019; Miller et al., 2016)。利用生理性別與環境因子分析數據能幫助偵測出有意義的影響,同時能依此回過頭幫助減少混淆變項以及實驗所需的累計數。
- 第二步。基於生理性別的檢定:對雄性與雌性測試假說,並對兩者進行檢定確認影響。欲調查動物的生理性別處置之交互作用時,可考慮使用複因子設計以減少樣本數量(Beery, 2018; Lazic, 2018)。
- 第三步。生理性別間的比較:檢定研究以確認真正的「生理性別影響」。測試生理性別影響會有費用的支出,然而,一個明確的生理性別差異能為性別特定研究帶來正當理由,畢竟造成某一性別的傷害對於社會及個別患者而言更是代價不斐。總得來說,在基礎科學階段便釐清生理性別,會比在花費更高的臨床階段來得更為實惠(Klein et al., 2015)。分析生理性別能夠減低在發展階段時失敗的藥物數量,亦能幫助藥廠防止因為藥物對某一性別的不良事件而被迫將藥物下架的狀況。
- 研究人員亦應評估群體間的重疊性(雄性與雌性間的相似性),以及群體內的差異性(雄性之間或雌性之間的差異)。應避免過度強調生理性別差異。
- 未找到生理性別影響亦應加以報告。為了減少發表偏誤,未有偵測到生理性別差異(主要影響或交互影響)或是與生理性別差異相關之資料未能有明確數據結論時,研究人員皆應加以說明(Wizemann, 2012)。報告零實驗結果對整合分析至關重要。
- 針對不會呈現生理性別差異的表型,未來的實驗都應該納入不同生理性別;亦即,實驗中的每個受測群體都應包括隨機選取之相同數量的雌性與雄性。並非所有實驗都需要有評估生理性別差異的設計。然而,每個實驗中受試動物的生理性別都應加以說明,以確保該實驗得以再現,且其在單一生理性別中的發現不會被過度普及至其他性別(Wizemann, 2012)。
- 分析性賀爾蒙的影響
- 在一個包含了近萬項特徵的整合分析中,Prendergast等人(2014)發現在大多數的生物性測量中,雌性的變異並不會比雄性更多(Itoh & Arnold, 2015; Becker et al., 2016)。其他因子,包括群體飼養對比單獨飼養,對於特徵的變異性可能會比動情週期階段的影響更大。
考量動情週期(Byers et al., 2012)。研究顯示,多數的生理性別影響並不是受到週期的影響(Becker et al., 2005)。研究人員應比較雌性與雄性反應的變異性。除非雌性變異較多,否則研究人員不需要監控動情週期。
停經模型。停經是實驗動物研究中逐漸浮現的一個領域。囓齒動物會發生生殖衰老,而這可用於加深對女性停經之了解的相關研究。雌鼠的生殖衰老約莫會在第一年末期開始,時間點會依品系及環境因素而有所變化(Finch et al., 1984)。雌鼠在超過一歲之後會呈現血清性類固醇低下(持續動情間期)以及/或慢性的血清雌激素升高(持續動情)的狀況(Finch et al., 1984)。持續動情最終將導致動情間期的狀況,但依照物種的不同,中間可能會有一個假妊娠的階段(Finch et al., 1984)。卵巢切除因為急遽減低了性類固醇,因而會有彷似生殖衰老的現象,且這個「真正的停經」有著許多的影響。一個逐漸受到矚目的領域是停經對於免疫系統的影響。於囓齒動物中,卵巢切除「降低了淋巴球趨化性、致裂物質引起的T細胞增殖反應,以及(介白素-2)生成」(Marriott & Huet-Hudson, 2006)。
妊娠或假妊娠。美國食藥署自1980年以來認證的藥物中,僅有不到10%對於出生缺陷的風險有足夠的資訊(Adam et al., 2011; Mishra & Mohanty, 2010)。新的藥物安全動物研究應該觸及母獸及胎兒於孕期與哺乳期之影響(McDonnell-Dowling & Kelly, 2015)。
藥物動力學。動情週期也會對藥物動力學造成影響。舉例而言,Kulkarni等人(2012)發現帶有抗氧化特性的大豆異黃酮之口服生物利用度與雌激素的濃度(影響肝臟對於藥物處置之調節)有著反向相關。
- 調查環境如何與生理性別交互作用
- 為了避免攻擊行為,雄性囓齒動物通常是以小群體或是單獨關籠飼養。獨居的囓齒動物「耗費較多能量維持體溫,這可能會造成參數的差異,例如熱量攝取、肌肉活動、代謝率、脂肪分佈或體型大小等,並對於身體與細胞的活動有著過多的潛在下游影響」(Ritz et al., 2014)。相反地,雌性則通常會關在一起以降低成本。群居的囓齒類通常會成群睡在一起,因此耗費了較少能量在維持體溫上。在這個情境中,可能會被認為有「生理性別差異」,但事實此差異可能是不同的居住環境所造成的結果。
- 相同大小的群體可能會對雌性與雄性造成不同的壓力源。單獨籠養也可能造成壓力(Ritz et al., 2014),但是獨居對雌性與雄性都能降低特性變異數(Prendergast et al., 2014)。
- 群體籠養亦可能產生自感的或社交性的掉毛,又稱作理毛(動物間相梳毛)(Kaleuff et al., 2006)。理毛(1)在同性群體籠養中常反映了社會階級(雌性與雄性皆同);(2)可能造因於過度擁擠的壓力;(3)發生在繁殖群體中(雌性為雄性理毛);以及(4)發生在哺乳中的囓齒類(幼鼠為母鼠理毛)。理毛在部份品系中更常發生。
- 籠子的尺寸可能會限制動物的行為。舉例而言,很多的籠子無法完全地適應雌性多樣的交配行為。在野外時,雌性可能會猛衝、接近並向雄性求歡(Birke, 2011)。據此,文章中應該闡明其居住環境。
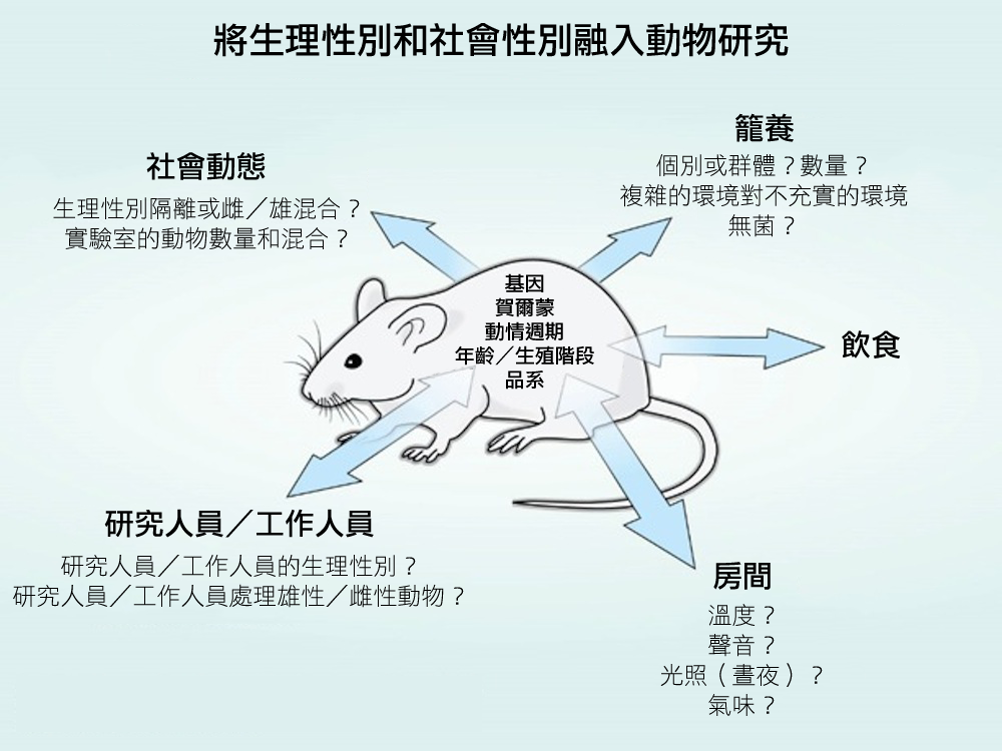
動物研究包含了生理性別(生物性特徵,例如基因、賀爾蒙、年齡、生殖階段、品系等等)與實驗室環境(例如籠養、研究人員之態度與行為、室溫、飲食等等)的交互作用。雙向箭頭代表了生理性別與環境之間的交互作用。環境過程,例如籠養的執行或有差別的處理,可能會對於雌性與雄性動物有著不同的影響。研究人員不該將環境狀況造成的影響誤認為出自生理性別(或生物性特徵)的影響。
籠養:單獨vs.群體
研究人員/工作人員。在囓齒動物研究中,壓力扮演相當重要的因素,實驗人員亦是個混淆變項。一項研究發現,大鼠與小鼠在面對男性實驗人員時呈現的疼痛反應比面對女性實驗人員時為低。雌雄鼠都呈現了這樣的反應,但雌性較為顯著。研究人員將這個「男性觀察員效應」視為對於雄烯酮及雄二烯酮的一個壓力反應,這些腋生分泌物在男(雄)性身上的濃度比女 (雌)性更高。除了壓力誘發的痛覺缺失外,這些化合物的出現也造成了血漿皮質固酮的增加(Sorge et al., 2014)。
操作。控制組的囓齒動物應該經歷與實驗組囓齒動物類似的壓力程序,例如假手術(sham surgeries)。 進行陰道塗片以確定雌性囓齒動物的發情週期階段可能會帶來壓力;雄性囓齒動物應以類似方式處理(Becker et al,2005)。若缺少這些控制,壓力反應的差異可能會被誤認為是其他的生理性別差異。
生理時鐘。睪固酮會依照生理時鐘有著季節性的變化。同樣地,雌性的賀爾蒙濃度也會依發情周期在一天之內而有波動。下視丘-腦垂腺-腎上腺(HPA)分泌會在一天之中有變化,同時也會影響性腺的分泌(Becker et al., 2005)。研究人員應闡明動物群體的光照期以及測量進行的時間點。
社會動能。 Edelmann等人 (2013)發現大鼠的母育行為中介了青少年鼠之間遊戲中的生理性別差異。除了一般的母育照顧外,被誘發的母育理毛行為會減少雄性遊戲但對雌性不會。這個影響可能來自於血清素傳遞的增加,因為母育舔舐亦會增加血清素受體mRNA。
溫度。實驗小鼠通常會被養在比牠們的中間溫度帶更低的溫度中。Gaskill等人 (2009)發現若小鼠能夠在三個不同溫度的籠子間移動時,兩種生理性別的小鼠都偏好在較暖和的環境中進行靜態及維持行為(動態行為則無偏好)。雌鼠偏好最高的溫度;雄鼠對中等及最高溫度之間則無偏好。與白日長度一樣,研究群體所處的環境溫度也應該有持續的紀錄報告。
飲食。飲食影響了體重、代謝、賀爾蒙量以及免疫功能;因此飲食配方應加以紀錄報告之(Bhupathy et al., 2010; Luczak et al., 2011)。Glover 與 Assinder(2006)發現富含植物性雌激素的飲食對於心臟健康有著生理性別的特定影響。對於雄性而言,以黃豆為基底的飲食會顯著降低心臟功能、增加肌細胞紊亂,並導致與心臟衰竭有關連的肌凝動力蛋白β-MyHC之增加。後者影響在較少數的雌性中亦有發現。
墊料。墊料也可能對賀爾蒙狀態造成影響。有報告顯示,相較於紙板基底的墊料,玉米芯墊料會因為影響大腦的雌激素接受體α而降低了攻擊行為(Landeros et al., 2012)。過往亦有報告指出飼養於玉米芯墊料上的小鼠之非雌激素絲裂原量有增加的現象(Markaverich et al., 2002)。
分析生理性別與環境—以及兩者如何交互作用—對於動物模型的轉譯價值之提昇相當重要。發展一項藥物的花費大約需要3億5千萬至50億美元—平均花費估計介於20億至30億美元間;而95%的候選藥物是失敗的(DiMasi et al, 2016; Arrowsmith, 2011; Herper, 2013)。將生理性別與社會性別納為研究變因可幫助降低成本,提升疾病機轉的探索並且拯救性命。
相關案例研究
參考資料
Adam, M., Polifka, J., & Friedman, J. (2011). Evolving knowledge of the teratogenicity of medications in human pregnancy. American Journal of Medical Genetics, Part C., 157, 175-182.
Arrowsmith, J. (2011). Trial watch: phase ii failures: 2008–2010. Nature Reviews Drug Discovery, 10, 328-329.
Becker, J. B., Prendergast, B. J., & Liang, J. W. (2016). Female rats are not more variable than male rats: a meta-analysis of neuroscience studies. Biology of sex differences, 7(1), 34.
Beery, A. K. (2018). Inclusion of females does not increase variability in rodent research studies. Current Opinion in Behavioral Science, 23, 143–149.
Beery, A., & Zucker, I. (2011). Sex bias in neuroscience and biomedical research. Neuroscience and Biobehavioral Reviews, 35(3), 565-572.
Buch, T., Moos, K., Ferreira, F. M., Fröhlich, H., Gebhard, C., & Tresch, A. (2019). Benefits of a factorial design focusing on inclusion of female and male animals in one experiment. Journal of Molecular Medicine, 97(6), 871-877.
Bhupathy, P., Haines, C., & Leinwand, L. (2010). Influence of sex hormones and phytoestrogens on heart disease in men and women. Women's Health 6(1), 77–95.
Birke, L. (2011). Telling the rat what to do: laboratory animals, science, and gender. In Fisher, J. A. (Ed.), Gender and the Science of Difference; Cultural Politics of Contemporary Science and Medicine (pp. 91-107). New Brunswick: Rutgers University Press.
Byers, S., Wiles, M., Dunn, S., & Taft, A. (2012). Mouse estrous cycle identification tool and images. PLoS ONE, 7(4). doi:10.1371/journal.pone.0035538.
DiMasi, J. A., Grabowski, H. G., & Hansen, R. W. (2016). Innovation in the pharmaceutical industry: new estimates of R&D costs. Journal of Health Economics, 47, 20–33.
Edelmann, M. N., Demers, C. H., & Auger, A. P. (2013). Maternal touch moderates sex differences in juvenile social play behavior. PLoS ONE, 8(2). doi:10.1371/journal.pone.0057396
Finch, C. E., Felicio, L. S., Mobbs, C. V., & Nelson, J. F. (1984). Ovarian and steroidal influences on neuroendocrine aging processes in female rodents. Endocrine Reviews, 5(4) 467-497.
Gaskill, B. N., Rohr, S. A., Pajor, E. A., Lucas, J. R., & Garner, J. P. (2009). Some like it hot: mouse temperature preferences in laboratory housing. Applied Animal Behavioral Science, 116, 279-285.
Glover A., & Assinder S. J. (2006). Acute exposure of adult male rats to dietary phytoestrogens reduces fecundity and alters epididymal steroid hormone receptor expression. Journal of Endocrinology, 189(3), 565-573.
Herper, M. (2013, August 11). The cost of creating a new drug now $5 billion, pushing big pharma to change. Forbes.
Itoh, Y., & Arnold, A. P. (2015). Are females more variable than males in gene expression? Meta-analysis of microarray datasets. Biology of Sex Differences, 6(1), 18.
Kaleuff, A., Minasyan, A., Keisala, T., Shah, Z., & Tuohimaa, P. (2006). Hair barbering in mice: implications for neurobehavioral research. Behavioral Processes, 71(1), 8-15.
Klein, S. L., Schiebinger, L., Stefanick, M. L., Cahill, L., Danska, J., De Vries, G. J., ... & Zucker, I. (2015). Opinion: sex inclusion in basic research drives discovery. Proceedings of the National Academy of Sciences, 112(17), 5257-5258.
Kulkarni K. H., Yang, Z., Niu, T, & Hu, M. (2012). Effects of estrogen and estrus cycle on pharmacokinetics, absorption, and disposition of genistein in female Sprague-Dawley rats. Journal of Agricultural and Food Chemistry, 60, 7949-7956.
Landeros, R. V., Morisseau, C., Yoo, H. J., Fu, S. H., Hammock, B. D., & Trainor, B. C. (2012). Corncob bedding alters the effects of estrogens on aggressive behavior and reduces estrogen receptor-α expression in the brain. Endocrinology, 153(2), 949-953.
Lazic, S. E. (2018). Four simple ways to increase power without increasing the sample size. Laboratory animals, 52(6), 621-629.
Luczak, E. D., Barthel, K. K., Stauffer, B. L., Konhilas, J. P., Cheung, T. H., & Leinwand, L. A. (2011). Remodeling the cardiac transcriptional landscape with diet. Physiological genomics, 43(12), 772-780.
Markaverich, B., Mani, S., Alejandro, M. A., Mitchell, A., Markaverich, D., Brown, T., ... & Faith, R. (2002). A novel endocrine-disrupting agent in corn with mitogenic activity in human breast and prostatic cancer cells. Environmental health perspectives, 110(2), 169-177.
Marriott, I., & Huet-Hudson, Y. (2006). Sexual dimorphism in innate immune responses to infectious organisms. Immunologic Research, 34(3), 177-192.
McCarthy, M., & Becker, J. (2002). Neuroendocrinology of sexual behavior in the female. In Becker, J., Breedlove, S., Crews, D., & McCarthy, M. (Eds.), Behavioral Endocrinology (pp. 124-132). Cambridge: MIT Press.
McDonnell-Dowling, K., & Kelly, J. (2015). Sources of variation in the design of preclinical studies assessing the effects of amphetamine-type stimulants in pregnancy and lactation. Behavioural Brain Research, 279, 87-99.
Mehta, L. S., Beckie, T. M., DeVon, H. A., Grines, C. L., Krumholz, H. M., Johnson, M. N., ... & Wenger, N. K. (2016). Acute myocardial infarction in women: a scientific statement from the American Heart Association. Circulation, 133(9), 916-947.
Miller, L. R., Marks, C., Becker, J. B., Hurn, P. D., Chen, W. J., Woodruff, T., ... & Makris, S. (2016). Considering sex as a biological variable in preclinical research. The FASEB Journal, 31(1), 29-34.
Miller, V. M., Kaplan, J. R., Schork, N. J., Ouyang, P., Berga, S. L., Wenger, N. K., ... & Taylor, D. A. (2011). Strategies and methods to study sex differences in cardiovascular structure and function: a guide for basic scientists. Biology of Sex Differences, 2(1). doi: 10.1186/2042-6410-2-14
Mishra, A. & Mohanty, B. (2010). Effect of lactational exposure of olanzapine on body weight of mice: a comparative study on neonates of both the sexes during post-natal development, Journal of Psychopharmacology, 23(7), 1089-1096.
Ouyang, P., Wenger, N. K., Taylor, D., Rich-Edwards, J. W., Steiner, M., Shaw, L. J., ... & Merz, N. B. (2016). Strategies and methods to study female-specific cardiovascular health and disease: a guide for clinical scientists. Biology of Sex Differences, 7(1), 19.
Prendergast, B. J., Onishi, K. G. & Zucker, I. (2014). Female mice liberated for inclusion in neuroscience and biomedical research. Neuroscience and Biobehavioral Reviews, 40, 1–5.
Regensteiner, J. G., Golden, S., Huebschmann, A. G., Barrett-Connor, E., Chang, A. Y., Chyun, D., ... & Reusch, J. E. (2015). Sex differences in the cardiovascular consequences of diabetes mellitus: a scientific statement from the American Heart Association. Circulation, 132(25), 2424-2447.
Ritz, S., Antle, D., Côté, J., Deroy, K., Fraleigh, N., Messing, K., Parent, L., St-Pierre, J., Vaillancourt C., & Mergler, D. (2014). First steps for integrating sex and gender considerations into basic experimental biomedical research. The FASEB Journal, 28(1), 4-13. doi: 10.1096/fj.13-233395.
Sorge, R., Martin, L., Isbester, K., Sotocinal, S., Rosen, S., Tuttle, A., Wieskopf, J., Acland, E., Dokova, A., Kadoura, B., Leger, P., Mapplebeck, J., McPhail, M., Delaney, A., Wigerblad, G., Schumann, A., Quinn, T., Frasnelli, J., Svensson, C, Sternberg, W., & Mogil, J. (2014). Olfactory exposure to males, including men, causes stress and related analgesia in rodents. Nature Methods, 11, 629–632.
Wizemann, T. (Ed.) (2012). Sex-Specific Reporting of Scientific Research: A Workshop Summary. Washington, D.C.: National Academies Press.