系統生物學:
分析生理∕社會性別如何交互作用
議題
生理性別和社會性別角色會對人體新陳代謝造成影響。因此,許多非傳染性疾病的預防和治療需要有與生理性別相關且與社會性別相關的方法。系統生物學是種對於生物系統的綜合整體理解。它是當今所謂的系統醫學的一部分,旨在透過對代謝過程進行數學建模來預測個體的疾病風險和精確治療(Apweiler et al., 2018)。 這種疾病的動態模型主要立基於組學資料(例如基因組學、轉錄組學、蛋白質組學、代謝組學——Zewde, 2019)。然而,蒐集這些資料集時的生理性別偏見會進一步導致數學模型及其預測中的生理性別偏見。
方法:蒐集特定生理∕社會性別之資料
資料的數量、質量和準確性對研究成果具有重要影響。大型資料集的日益廣泛使用及其在精準醫學、藥物治療和營養等領域的整合,將此面向推向了最前線。在收集與生理性別相關的資訊時,需要針對如何操作生理性別做出明確的決定(例如,是單純透過基因組數據,亦或是要結合賀爾蒙狀態和表型)。 這同樣適用於這些分析中可能包含的社會性別。 目前,唯一立即可用的選項是收集有關社會性別認同的資料。 然而,隨著現代生物醫學技術變得更加完善,社會性別常模和行為相關資訊也變得可以加以收集。整合這些資訊是創建強大的疾病模型和產生新的個人化治療或預防措施的唯一方法。
性別化創新:
- 收集基因表現中的兩性異型資料可改進生物建模。對人類基因表現中的兩性異型之研究可以幫助進行準確的生物建模(Labonté et al., 2017)。此類研究還應考慮到不同的種族、文化和社會背景以及不同的生活方式。
- 收集生理性別和社會性別資料促進整合性體學。整合型體學為醫學、藥物治療和營養等各個領域的特定生理性別精準應用提供了基礎。當前的資料集未能充分代表女性,也未能充分報告參與者的社會性別認同(Gemmati et al., 2020)。
- 分析生理性別提高了對微生物組在健康和疾病中的作用之理解。在腸道微生物組中發現了生理性別差異。分析這些差異將提升我們對微生物組如何影響人類新陳代謝的理解,並將加強我們改善人類健康的努力。
- 整合生理性別差異改善系統生物學模型。研究人員和補助機構在糾正體學實驗中的生理性別偏見上有其作用。
議題
性別化創新1:收集基因表現中的兩性異型資料可改進生物建模
性別化創新2:收集生理性別和社會性別資料促進整合型體學
方法:蒐集特定生理∕社會性別之資料
性別化創新3:分析生理性別提高對微生物組在健康和疾病中的作用之理解
性別化創新4:整合生理性別差異改善系統生物學模型
結論
下一步
議題
這是一個跨學科的研究領域,專注於生物系統內復雜的交互作用(Tavassoly, Goldfarb, & Iyengar, 2018)。系統生物學讓我們了解多重環節之間的交互作用如何在個體層次上形成其功能網絡。例如,Tareen等人(2019)使用系統生物學來辨識組織用來選擇依賴葡萄糖或脂肪酸作為燃料的分子開關(Tareen et al., 2019)。系統生物學亦發展出了疾病的預測計算模型,將疾病分類法從表型轉變為分子,並且將能實現個人化/精準治療(Bielekova, Vodovotz, An, & Hallenbeck, 2014)。系統生物學家經常使用「體學」資料(基因體學、轉錄體學、蛋白質體學、代謝體學)來提供對於伴隨遺傳、文化、種族和社會對生物體影響之分子動力學的廣泛見解。例如,每天大量攝入脂肪(與文化和社會因素有關)會對體內組織的代謝功能產生負面影響,並增加罹患第二型糖尿病的風險。系統生物學家使用體學資料來了解組織不同時間的代謝狀態。由於臨床和體學資料中存在生理性別和社會性別偏見(Gemmati et al., 2020),當前的生物模型適用於順性別男性,而其他身體和社會性別的模型代表性則都不足。
性別化創新1:收集基因表現中的兩性異型資料可改進生物建模
動物器官和體液的體學研究已經證明了生物化學和基因活動調控中的生理性別差異。例如,在肝臟中,有超過 1000個基因在女性和男性中的表現不盡相同。代謝和基因調控途徑的生理性別差異也已在人類中得到證實。例如,根據德國KORA世代研究(Kooperative Gesundheitsforschung in der Region Augsburg奧格斯堡地區合作健康研究)之參與者血清的代謝體學分析顯示,131種受檢測的代謝物中有102種在濃度上存在顯著的生理性別差異(Mittelstrass et al., 2011)。特定生理性別全基因組關聯研究 (GWAS) 顯示,其中一些生理性別差異是由遺傳差異引起的。儘管有這些明顯的結果,但大多數系統生物學研究並未考慮生理性別。
人類兩性異型的相關資料有限。由於無法從活體個體的許多器官中獲取活檢材料,因此需要設計新的策略來加強對基因組表現中的兩性異型之研究,例如使用 iPSC(誘導式多潛能幹細胞)或類器官。理想情況下,此類研究應考慮生活方式、種族、文化和社會背景的差異,將交織性因子納入資料集當中。

性別化創新2:收集生理性別和社會性別資料促進整合型體學
整合型體學是精準醫學、藥物治療和營養學的基礎(Karczewski & Snyder, 2018)。體學資料的統合分析是為預防疾病發作尋找新的診斷生物標記、藥物標靶或營養途徑的一種方法。將生理性別和社會性別認同整合到整合型體學的原始資料中將是邁向更加個人化之醫療必不可少的第一步。當前的資料集對女性的代表性不足,並且缺乏和參與者之社會性別認同相關的資訊。關於社會性別認同之影響的資訊,2018 年時展開了瑞典社會性別不安治療 (GETS) 研究,旨在調查用來讓社會性別認同與外貌相符的跨性賀爾蒙治療會否且如何導致代謝和功能之變化,包括在基因組和表觀基因組之層次(Wiik et al., 2018)。包含了社會和文化資訊的大數據可以為生理性別特定和社會性別特定之精準醫學開闢道路(Das et al., 2020)。
方法:蒐集特定生理∕社會性別之資料
資料的數量、質量和準確度對研究成果具有重要影響。大型資料集日益廣泛的使用及其在精準醫學、藥物治療和營養等領域的整合,使得此領域成了顯學。 在收集有關生理性別的資訊時,需要就生理性別將會以何種方式操作做出明確的決定(例如,是單純透過基因組數據,亦或是要結合賀爾蒙狀態和表型)。 這同樣適用於這些分析中可能包含的社會性別。目前,唯一立即可用的選項是收集有關社會性別認同的資料。然而,隨著工具變得更加完善,也可以進一步收集關於社會性別常規和行為的資訊。 這些資訊的整合將能產生新的個人化療法或預防措施。
性別化創新3:分析生理性別提高對微生物組在健康和疾病中的作用之理解
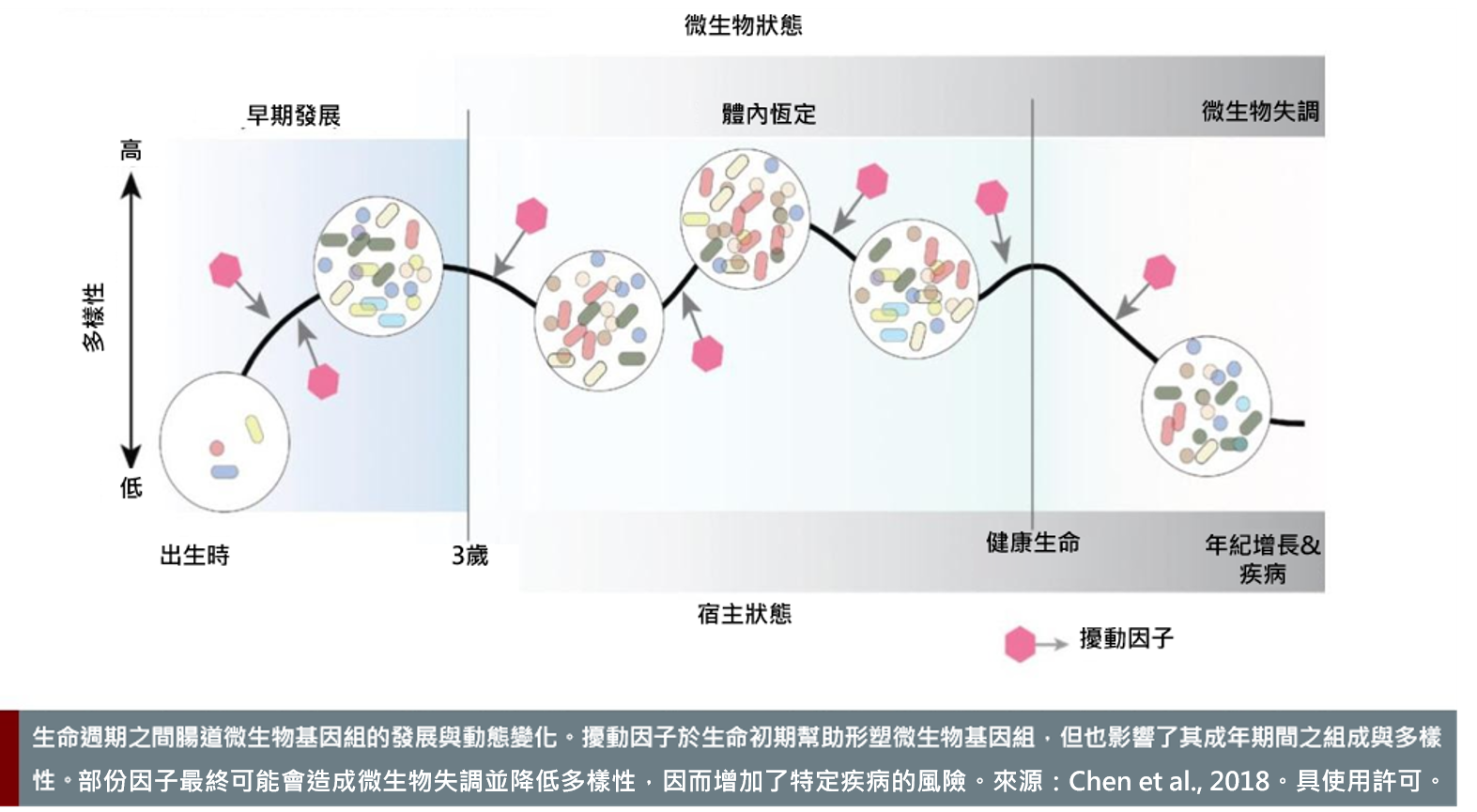
人們對於腸道微生物體在健康和疾病中擔任的角色越來越留意。藉由以基因定序構建總體基因體學,研究人員現在可以分析微生物體的組成並量化我們腸道中不同類型的微生物。微生物體會受宿主基因組成以及文化和社會環境所影響。這樣的定序發現了女性和男性的微生物體有所差異。微生物體的生理性別差異不僅可能導致腸道相關疾病的生理性別差異,還可能導致神經系統和神經退化性疾病的生理性別差異(Thion et al., 2018) (H2020-EU.3.1.1. ID:733100, SYSCID)。研究顯示,女性的微生物體之多樣性往往顯著地比男性更高(Chen et al. 2018)。微生物體的構成可能會受到含有雌激素的避孕藥的影響,雌激素會改變腸道中的生長條件。女性的微生物體對各類抗生素表現出更高的抗藥性,這似乎與抗生素使用的差異有關(Sinha et al., 2019) (H2020-EU.1.1. ID: 715772, BabyVir)。這些新的觀察值得更深入的調查,並可能促成健康和疾病的特定生理性別分析。
性別化創新4:整合生理性別差異改善系統生物學模型
由於生物醫學實驗較常使用雄性動物和人類,因此系統生物學研究人員較容易接觸到雄性的相關資料。因此,生物學中的數學模型主要是基於雄性資料。為了縮小不同生理性別的動物數量上的差距,期刊和補助機構應推廣雌性資料的收集,這是與促使雌性模型與雄性模型的生成並駕齊驅之先決條件。此外,可用的體學資料集通常由混合的雌性和雄性資料組成,然而生理性別和社會性別在分析時卻被視為混擾因子。建議系統生物學家系統性地標記資料的生理性別,並在其構建的模型中考慮到這一點。
Naik等人(2014)使用肝臟代謝數據建構了電腦預測模型SteatoNet,以增強對肝病病因研究的理解——但該模型僅對男性有效(Naik, Rozman, & Belic, 2014)。Cvitanovic Tomas 等人(Cvitanovic Tomas, Urlep, Moskon, Mraz, & Rozman, 2018)透過使用雌激素和雄激素受體反應的數據以及隨之而來的生長激素釋放差異的數據,對SteatoNet進行了調整以納入生理性別差異。他們稱他們的計算模型為 LiverSex,並希望它能提供對與生理性別相關的肝臟病理的洞察。它已經在老鼠身上得到驗證,但還沒有在人類身上得到驗證。
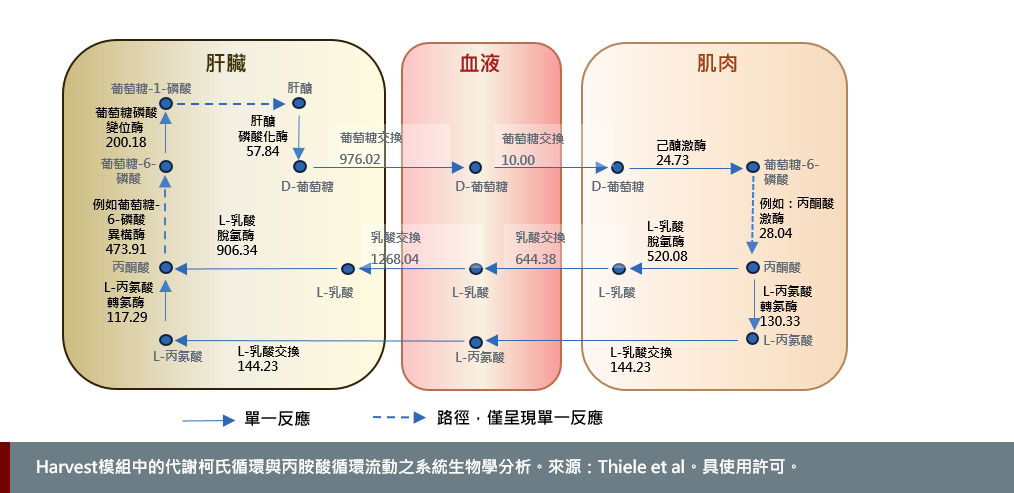
在生理學和新陳代謝的背景下,盧森堡大學和萊登大學的研究人員最近提出了兩種經過驗證的、特定生理性別的全身代謝重建,名為Harvey和Harvetta (Thiele et al., 2018)。這些模型代表了20個器官、6個性器官、6種血細胞、全身血液循環、血腦屏障和具有微生物組的胃腸腔的代謝。在無法進行實驗測試的情況下,例如孕婦,此類模型具有用於確定治療方法之潛力。
結論
人類新陳代謝會受生理性別和社會性別的影響,其中遺傳背景會與包括生活方式、種族、文化和社會規範在內的環境因素相互作用。系統生物學是一門相對較新的學科,對醫學科學的影響亦越來越大。在不久的將來,它將能促使數學模型的建構,用以預測常見的非傳染性疾病之個人風險,並加以指引預防或治療的最佳方法。建模主要奠基於體學資料,目前關於生理性別與社會性別的資訊尚相當缺乏:
- 在不同生活條件下對人類進行的兩性異型研究有助於生物建模。
- 綜合體學將使疾病預防和治療的方法更加個人化。原始資料需要包含與生理性別和社會性別(包括順性別與非二元性別)相關的資訊。
- 腸道微生物體在健康和疾病風險中有其作用。由於微生物體會因生理性別而異,因此對微生物體的分析應將生理性別作為穩定變項納入其中。
- 儘管目前已有了一些人類新陳代謝之男性與女性模型的開發示例,但大多數模型是使用男性或女性/男性混合資料生成的。
- 在這些情況下,應該解決模型的局限性。在某些情況中,模型是可加以改造並納入生理性別的。
下一步
在系統生物學中,生理性別和社會性別的影響所受到關注非常有限。然而,系統生物學仍然是個新興領域。現在正是將生理性別與社會性別視作重要參數納入體學實驗和數學建模設計的時候。研究人員、期刊和補助機構可以提升對於單一生理性別資料集之局限性的警覺,並且讓生理性別和社會性別分析成為基因體學、遺傳學和系統生物學研究的常模。
參考資料
Apweiler R. et al. (2018). Whither systems medicine? Experimental & Molecular Medicine, 50, e453.
Bielekova, B., Vodovotz, Y., An, G., & Hallenbeck, J. (2014). How implementation of systems biology into clinical trials accelerates understanding of diseases. Frontiers in neurology, 5.
Bielekova, B., Vodovotz, Y., An, G., & Hallenbeck, J. (2014). How implementation of systems biology into clinical trials accelerates understanding of diseases. Front Neurol, 5, 102. doi:10.3389/fneur.2014.00102
Cvitanovic Tomas, T., Urlep, Z., Moskon, M., Mraz, M., & Rozman, D. (2018). LiverSex Computational Model: Sexual Aspects in Hepatic Metabolism and Abnormalities. Front Physiol, 9, 360. doi:10.3389/fphys.2018.00360
Das A.V. et al. (2020). Clinical profile of pterygium in patients seeking eye care in India: electronic medical records-driven big data analytics report III. Int. Ophtalmol, 24 February.
Gemmati D. et al. (2020). "Bridging the Gap"everything that could have been avoided if we had applied gender medicine, pharmacogenetics and personalized medicine in the gender-omics and sex-omics era. Int J Mol Sci, 21, 296.
Karczewski, K. J., & Snyder, M. P. (2018). Integrative omics for health and disease. Nat Rev Genet, 19(5), 299-310. doi:10.1038/nrg.2018.4
Labonté B. et al. (2017). Sex-specific transcriptional signatures in human depression. Nat Med, 23 (9), 1102-1111.
Mittelstrass, K., Ried, J. S., Yu, Z., Krumsiek, J., Gieger, C., Prehn, C., . . . Illig, T. (2011). Discovery of sexual dimorphisms in metabolic and genetic biomarkers. PLoS Genet, 7(8), e1002215. doi:10.1371/journal.pgen.1002215
Naik, A., Rozman, D., & Belic, A. (2014). SteatoNet: the first integrated human metabolic model with multi-layered regulation to investigate liver-associated pathologies. PLoS Comput Biol, 10(12), e1003993. doi:10.1371/journal.pcbi.1003993
Sinha, T., Vich Vila, A., Garmaeva, S., Jankipersadsing, S. A., Imhann, F., Collij, V., . . . Zhernakova, A. (2019). Analysis of 1135 gut metagenomes identifies sex-specific resistome profiles. Gut Microbes, 10(3), 358-366. doi:10.1080/19490976.2018.1528822
Tareen, S. H., Kutmon, M., Arts, I. C., de Kok, T. M., Evelo, C. T., & Adriaens, M. E. (2019). Logical modelling reveals the PDC-PDK interaction as the regulatory switch driving metabolic flexibility at the cellular level. Genes Nutr, 14, 27. doi:10.1186/s12263-019-0647-5
Tavassoly, I., Goldfarb, J., & Iyengar, R. (2018). Systems biology primer: the basic methods and approaches. Essays Biochem, 62(4), 487-500. doi:10.1042/ebc20180003
Thiele, I., Sahoo, S., Heinken, A., Heirendt, L., Aurich, M. K., Noronha, A., & Fleming, R. M. T. (2018). When metabolism meets physiology: Harvey and Harvetta. bioRxiv, 255885. doi:10.1101/255885
Thion, M. S., Low, D., Silvin, A., Chen, J., Grisel, P., Schulte-Schrepping, J., . . . Garel, S. (2018). Microbiome Influences Prenatal and Adult Microglia in a Sex-Specific Manner. Cell, 172(3), 500-516.e516. doi:10.1016/j.cell.2017.11.042
Wiik, A., Andersson, D. P., Brismar, T. B., Chanpen, S., Dhejne, C., Ekstrom, T. J., . . . Gustafsson, T. (2018). Metabolic and functional changes in transgender individuals following cross-sex hormone treatment: Design and methods of the GEnder Dysphoria Treatment in Sweden (GETS) study. Contemp Clin Trials Commun, 10, 148-153. doi:10.1016/j.conctc.2018.04.005
Zewde T.N. (2019) Multiscale solutions to quantitative systems biology models. Front Mol Biosci, 6, 119.
系統生物學是對生物系統的綜合整體理解。它是現在所謂的系統醫學當中的一部分,旨在透過對於代謝過程進行數學建模來預測個體疾病風險和精確治療。生理性別和社會性別角色會影響人體的新陳代謝。因此,許多非傳染性疾病的預防和治療需要與生理性別和社會性別相關之取徑。
性別化創新:
- 收集基因表現中的兩性異型資料可改進生物建模。對人類基因表現之兩性異型的研究有助準確的生物建模之進行。 此類研究亦應考慮到不同的族裔、文化和社會背景以及不同的生活方式。
- 收集生理性別和社會性別資料促進整合型體學。整合型體學為醫學、藥物治療和營養等各個領域的特定生理性別精準應用奠定了基礎。當前的資料集中的女性代表性不足,且未充分說明參與者的社會性別認同。
- 生理性別分析提高了對微生物體在健康和疾病中之作用的理解。腸道微生物體中存在著生理性別差異。分析這些差異將有助於我們理解微生物體對於人類新陳代謝的影響,並將加強我們改善人類健康的努力。