生理性別決定的遺傳學:
重新思考概念與理論
議題
先前生理性別決定研究主要著重於睪丸發展,而控制卵巢的主動發育過程卻被大大地忽略了(Veitia, 2010)。事實上,卵巢的發育長期以來被認為是生殖腺雙向分化能力的「預設」或「被動」發育結果。
方法:重新思考研究概念與理論
將女性生殖途徑設有「預設值」的看法將研究鎖定於睪丸的分化以及發現Sry基因後其下游的目標基因,例如:Sox9。相反地,卵巢發育路徑卻比較少探討。科學模型將女性發育路徑描述為「預設」模式與透納氏症候群缺乏卵巢發育等問題不符。
性別化創新:
-
將卵巢發育視為主動發展過程。
目前的研究以辨識卵巢主動發育所需的機制為主(Veitia, 2010; Uhlenhaut et al., 2009)。這些研究增加了睪丸發育以及卵巢和睪丸發育途徑相互作用方面的知識。
-
發現正在進行之卵巢和睪丸的維持過程。
卵巢發育途徑的研究顯示,轉錄調節因子FOXL2必須表現於成人之卵巢濾泡以避免「將成人卵巢轉分化為睪丸」(Uhlenhaut et al., 2009)。接著,研究人員發現,為避免睪丸之塞特利氏細胞被重新編碼為顆粒細胞,轉錄因子DMRT1的存在是必要的(Matson et al., 2011)。
-
以新語言描述生殖腺分化過程。
研究人員已經放棄「預設」概念並強調,男性與女性發育過程雖有差異,但卵巢建立過程實為主動發育過程(如同建立睪丸或其他任何器官發育過程的概念)。每條發育路徑都由一連串複雜的基因產物以適當劑量在精準的時機串連而成。
將女性發育視為荷爾蒙預設的概念
將女性發育視為基因預設的概念
議題:「預設」的概念以及其對研究的影響
性別化創新 1:將卵巢發育視為主動發展過程
方法:重新思考概念與理論
性別化創新2:發現持續進行之卵巢和睪丸的維持過程
性別化創新3:以新語言描述生殖腺的分化過程
方法:重新思考研究優先次序與成果
結論
將女性發育視為荷爾蒙預設的概念
胚胎生殖腺的發育是具雙向潛能的,也就是說,它在正常情況下會「擇一發展成為睪丸或卵巢,而這兩種器官的型態與功能各不相同」(Capel et al., 2006)。
1947年,Alfred Jost的研究顯示,當雌性(XX)和雄性(XY)胎兔在性別分化前於子宮內接受生殖腺切除術後,不論染色體核型生理性別為何,所有的個體其後皆有雌性的性導管及外生殖器(Jost, 1947)。
研究人員假設睪丸是藉由睪丸激素的刺激啟動雄性發育過程。牛隻的研究顯示,當異性胎兒的胎盤血管相互吻合時,其荷爾蒙會進行互換,進而讓核型XX的胎兒男性化,但是卻不會讓核型XY的胎兒女性化(Jost
et al., 1972)。基於這些結果以及其他研究的成果,預期缺乏睪丸激素會導致雌性發育。
將女性發育視為基因預設的概念
1905年Nettie Stevens與Edmund Wilson雙雙發現Y染色體,因而引進XX/XY生理性別決定系統的描述,也就是說女性為XX而男性為XY (Stevens, 1905; Wilson, 1905)。剛開始並不清楚人類生理性別是否由X 染色體的數目決定或是由Y染色體的存在與否決定。
隨後關於柯林菲特氏與透納氏症候群在1950 年代的研究顯示,人類的生理性別由Y染色體的存在與否決定(Jacobs et al., 1959; Ford, 1959)。如果生理性別由X 染色體的數目決定,有47條染色體(性染色體為XXY)的柯林菲特氏症候群病患應該會是女性,因為他們有女性性染色體(兩條X);而有45條染色體(性染色體為XO)的透納氏症候群病患應該會是男性,因為他們有典型男性X染色體的數目(一條X)。然而,柯林菲特氏症候群病患具有男性表現型,而透納氏症候群病患反而有女性表現型。
這些觀察將研究導向在Y染色體上尋找生理性別決定基因。1990年Andrew Sinclair和其同事發表在自然期刊的文章確定了一個可做為生理性別決定區域Y(SRY)的Y染色體基因,他們同時也承認可能需要許多不同的基因以決定男性和女性生理性別(Sinclair et al., 1990)。隨後的研究證實,如果在胚胎發育時期對XX小鼠注射帶有Sry去氧核醣核酸片段的製劑會促使其發育出睪丸(Koopman et al., 1991)。
人類患者的鑑定研究發現,帶有46條染色體,性染色體為XX的男性其實是因為其 SRY基因轉位至X染色體上。此研究結果進一步證實SRY基因已足夠啟動男性發育(Berkovitz et al., 1992)。因此後續幾年中的研究幾乎只著重於Sry基因的下游目標。
議題:「預設」的概念以及其對研究的影響
在此階段,生理性別決定研究著重於決定男性睪丸之遺傳學問題(Richardson, 2013)。相反地,女性性發育則被認為是一種Sry基因不存在時的「預設」發育過程。
「default」這個英文字代表「沒有行動;忽視」或是「沒有具體替代方案時,根據[…]事先選擇的選項」(Oxford English Dictionary, 2011)。在生理性別決定的個案中,「預設」成為演繹女性發育路徑的主流模型;亦即卵巢會導致其他作用的缺乏,因此鮮少有針對卵巢發育之研究。
當主流研究社群持續著重將睪丸決定途徑的遺傳學研究做為解開哺乳類動物性發育的關鍵時,某些發育生物學家開始對「預設」模型提出反對。舉例來說,1986年Eva Eicher和Linda
Washburn試圖挑戰「卵巢組織的誘導過程是一個被動(自動)事件」的觀念,爭論「卵巢組織的誘導過程,就如同睪丸組織的誘導過程或者任何細胞的分化過程一般,是一個主動、基因導向的發育過程」。這些生物學家注意到,「幾乎沒有任何文獻記載是哪些基因參與了從未分化生殖腺誘導出卵巢組織的過程」(Eicher et al., 1986; 亦見Fausto-Sterling, 1989)。
性別化創新 1:將卵巢發育視為主動發展過程
1990年代中期,發育生物學家意識到,「雖然與男性性分化有關的因素已被充分研究,調控女性性分化的路徑仍未完全明確」(see Biason-Lauber et al., 2008; Richardson, 2013)。
同時,從動物模式和人類病患而來的數據顯示生理性別決定涉及的層面比單純SRY基因的存在與否還要深廣。我們觀察到的現象包括:
-
SRY基因的缺乏並不足以建立一個具有功能性的卵巢,必須具備兩個X染色體。
有45條染色體,性染色體為XO的透納氏症候群女性病患,其卵巢會有功能障礙的問題,顯示兩個X染色體對正常的女性發育是必要的(Bondy, 2010)。這個卵巢功能障礙問題是因發育期間缺乏生殖細胞所致。要建立正常功能的卵巢必須有能發育的生殖細胞(Persani et al., 2009)。睪丸發育的不同點在於,具有「功能性」(荷爾蒙分泌能力)的睪丸可以在生殖細胞不存在的情況下發育,就像性染色體為XX的男性個案(Kim et al., 2010)。
-
對劑量敏感的基因即使有SRY 基因的存在下仍能推翻男性發育。
1994年,研究人員鑑定了有46條染色體(性染色體為XY)的女性,她們具備完整的SRY 基因,並且被判定其特定重複的X染色體基因座「在SRY 基因的存在下仍足以破壞睪丸發育」(Bardoni et al., 1994)。稍後的研究證實其中牽涉到的是DAX1基因。而有關這些具有46條染色體(性染色體為XY)女性的研究顯示,「DAX1複製基因在性染色體為XY 個體中會引起男轉女的生理性別轉換」(Ludbrook et al., 2004),只是這樣一來,DAX1基因「便可做為一種抗睪丸基因」(Sekido et al., 2009)。
重新概念化卵巢為「主動」途徑可以產生重要的性別化創新:研究人員可以開始確定發育過程中、出生後以及成年期製造和維持卵巢功能所需的特殊機制。此時也會有數種遺傳候選人的出現,包括:WNT4基因和FOXL2基因。研究人員此時才明白女性的性分化需要在整個成年期持續的維護——參見方法。而有些基因,例如WNT4,是女性性發育所需的特定基因,但是男性性發育則不需要(Swain et al., 1998)。
目前的研究顯示,男性與女性發育路徑需要依賴顯性作用基因,而SRY基因藉由正向調控SOX9基因表現,主動促進男性發育路徑。B-catenin、Rspo1基因和Foxl2基因會藉由抑制SOX9基因的表現主動促進女性發育路徑。決定哪條路徑勝出只是時機(和基因表現程度)問題而已(Sekido et al., 2008; Veitia, 2010)。見圖。
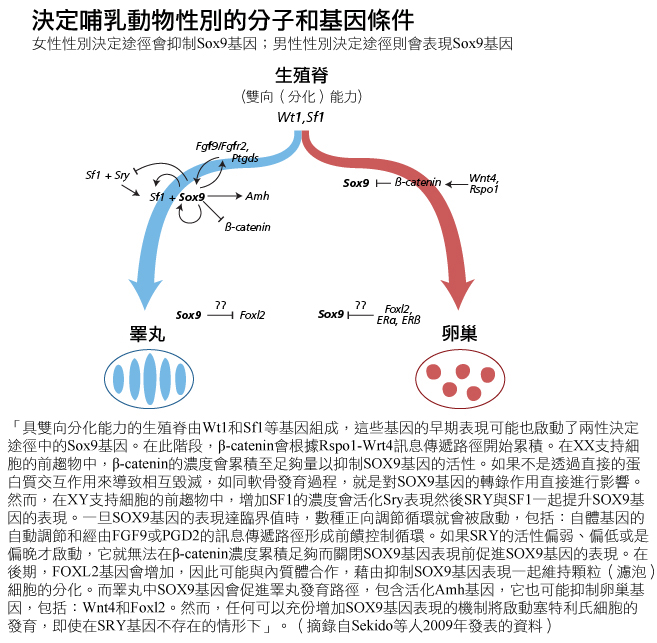
方法:重新思考概念與理論
理論與概念是形成研究優先次序的其中一個因子。在生理性別決定遺傳學中,生物學家沒有質問從1950至1960年代承襲而來有關卵巢發育「預設」模式的問題。女性「被動」發育的概念在更廣義的社群中符合現今科學理論與社會性別假設(Schiebinger, 1989; Richardson, 2013)。對理論的重新思考導致了關於卵巢發育的新問題,也因此發現一串卵巢功能所需之基因。數種「基因偵測實驗已顯示許多基因其實只表現於卵巢[中]」(Liu, 2010)。
性別化創新2:發現持續進行之卵巢和睪丸的維持過程
除了卵巢發育,研究人員企圖瞭解卵巢特有的病理狀況。生物學家研究與卵巢衰竭有關的眼瞼裂縫(瞼口)狹小/眼皮下垂/內眥贅皮反轉(先天性家族性瞼口狹小症,BPES)遺傳學時,確定FOXL2基因為維持卵巢功能的必要基因(Crisponi, 2001)。近期研究顯示,成年人中FOXL2基因是持續抑制SOX9基因所需的基因,也因此能避免卵巢濾泡細胞轉分化為「類睪丸」細胞(Uhlenhaut et al., 2009)。參見下圖(翻拍自Uhlenhaut等人2009年發表的資料)。
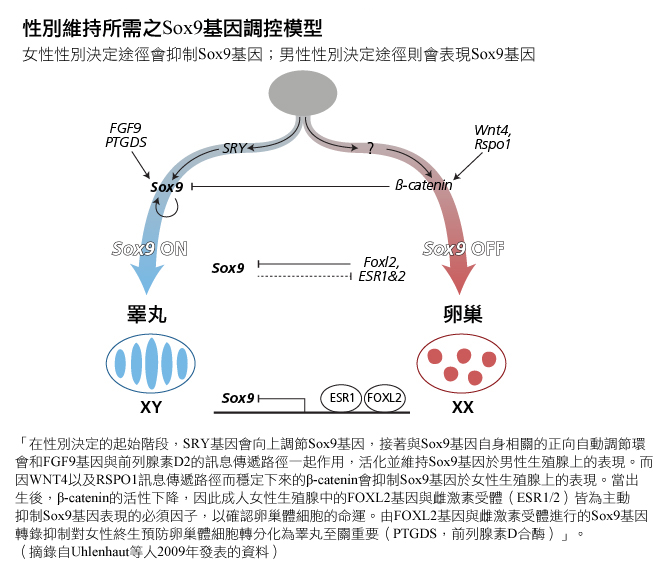
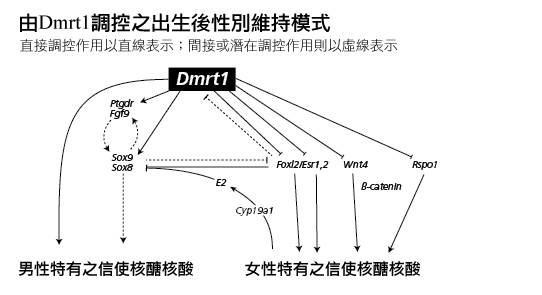
如同FOXL2基因,近期實驗顯示「男性生理性別決定並不是一個永久性的選擇,Dmrt1基因對睪丸功能的維持非常重要」(Herpin et al., 2011)。就如失去FOXL2基因能將卵巢顆粒細胞重新編碼為睪丸塞特利氏細胞,缺乏DMRT1基因可以將塞特利氏細胞重新編碼為顆粒細胞。DMRT1基因能抑制部分與卵巢發育相關的基因。參見下圖(改製自Matson等人2011年發表的資料)。
性別化創新3:以新語言描述生殖腺的分化過程
卵巢的決定過程不再被看作是由於缺乏SRY基因而自動導致卵巢發育的「預設」過程。研究人員現在反而把形成睪丸與卵巢的過程形容為兩種主動、需要一連串複雜的基因產物以適當劑量在精準的時機串連而成的路徑。參閱方法。
方法:重新思考研究優先次序與結果
在這個案例中,重新思考的概念和理論會讓我們反思研究的優先次序。從1940年代至1990年代的生理性別決定遺傳學重點放在睪丸從未分化的生殖腺誘導而來的相關研究,而只有少數研究著重於卵巢的發育途徑。儘管仍然存在許多問題,研究人員現在已經開始去辨識生產和維護卵巢活動所需的機制。這將反過來開啟維持睪丸功能的新研究。
結論
卵巢發育顯然不是預設或被動發育途徑。生物學家、遺傳學家與其他研究人員已經意識到瞭解卵巢發育對掌握生理性別決定遺傳學至關重要。關於卵巢主動發育途徑之新研究已經讓用於描述生理性別決定的語言產生變化。目前的措詞同時著重於驅動卵巢與睪丸形成的基因特性。
參考資料
Bardoni, B., Zanaria, E., Guioli, S., Floridia, G., Worley, K., Tonini, G., Ferrante, E., Chiumello, G., McCabe, E., Fraccaro, M., Zuffardi, O., & Camerino, G. (1994). A Dosage Sensitive Locus at Chromosome X021 is Involved in Male to Female Sex Reversal. Nature Genetics, 7 (4), 497-501.
Berkovitz, G., Fechner, P., Marcantonio, S., Bland, G., Stetten, G., Goodfellow, P., Smith, K., & Migeon, C. (1992). The Role of the Sex-Determining Region of the Y Chromosome (SRY) in the Etiology of 46,XX True Hermaphroditism. Human Genetics, 88 (4), 411-416.
Biason-Lauber, A., & Konrad, D. (2008). WNT4 and Sex Development. Sexual Development, 2 (4-5), 210-218.
Bondy, C. (2010). Turner Syndrome. In Carrell, D., & Peterson, C. (eds.), Reproductive Endocrinology and Infertility: Integrating Modern Clinical and Laboratory Practice, pp. 307-324. New York: Springer Science and Business Media.
Brennan, J., & Capel, B. (2004). One Tissue, Two Fates: Molecular Genetic Events that Underlie Testis versus Ovary Development. Nature Reviews Genetics, 5 (7), 509-521.
Capel, B., & Kim, Y. (2006). Balancing the Bipotential Gonad between Alternative Organ Fates: A New Perspective on an Old Problem. Developmental Dynamics, 235 (9), 2292-2300.
Cotinot, C., Pailhoux, E., Jaubert, F., & Fellous, M. (2002). Molecular Genetics of Sex Determination. Seminars in Reproductive Medicine, 20 (3), 157-168.
Crisponi, L., Deiana, M., Loi, A., Chiappe, F., Uda, M., Amati, P., Bisceglia, L., Zelante, L., Nagaraja, R., Porcu, S., Ristaldi, M., Marzella, R., Rocchi, M., Nicolino, M., Leinhardt-Roussie, A., Nivelon, A., Verloes, A., Schlessinger, D., Gasparini, P., Bonneau, D., Cao, A., & Pilia, G. (2001). The Putative Forkhead Transcription Factor FOXL2 is Mutated in Blepharophimosis/Ptosis/Epicanthus Inversus Syndrome. Nature Genetics, 27 (2), 159-166.
DiNapoli, L., & Capel, B. (2008). SRY and the Standoff in Sex Determination. Molecular Endocrinology, 22 (1), 1-9.
Eicher, E., & Washburn, L. (1986). Genetic Control of Primary Sex Determination in Mice. Annual Review of Genetics, 20, 327-60.
Fausto-Sterling, A. (1989). Life in the XY Corral. Women’s Studies International Forum, 12 (3), 319-331.
Ford, C., Miller, O., Polani, E., de Almeida, J., & Briggs, J. (1959). A Sex Chromosome Anomaly in a Case of Gonadal Dysgenesis (Turner’s Syndrome). Lancet, 1 (7075), 711-713.
Herpin, A., & Schartl, M. (2011). Sex Determination: Switch and Suppress. Current Biology, 21 (17), R656-R659.
Jacobs, P., & Strong, J. (1959). A Case of Human Intersexuality Having a Possible XXY Sex-Determining Mechanism. Nature, 4657 (183), 302-303.
Jost, A. (1972). A New Look at the Mechanisms Controlling Sex Differentiation in Mammals. Johns Hopkins Medical Journal, 130 (1), 38-53.
Jost, A. (1970). Hormonal Factors in the Sex Differentiation of the Mammalian Foetus. Philosophical Transactions of the Royal Society of London, 259, 119-130.
Jost, A. (1947). Recherches sur la Différenciation Sexuelle de l'Embryon de Lapin. Archives d'Anatomie Microscopique et de Morphologie Expérimentale, 36, 271–315.
Kim, J., Bak, C., Chin, M., Cha, D., Yoon, T., & Shim, S. (2010). SRY-Negative 46,XX Infertile Male with Leydig Cell Hyperplasia: Clinical, Cytogenetic, and Molecular Analysis and Review of the Literature. Fertility and Sterility, 94 (2), 753e5-753e9.
Koopman, P., Gubbay, J., Vivian, N., Goodfellow, P., & Lovell-Badge, R. (1991). Male Development of Chromosomally Female Mice Transgenic for SRY. Nature, (351), 117-121.
Liu, C. (2010). The Role of Beta-Catenin in the Development of Fetal Ovary and Female Germ Cells. Urbana-Champaign: Illinois Digital Environment for Access to Learning and Scholarship (IDEALS).
Loffler, K., Zarkower, D., & Koopman, P. (2003). Etiology of Ovarian Failure in Blepharophimosis Ptosis Epicanthus Inversus Syndrome: Foxl2 Is a Conserved, Early-Acting Gene in Vertebrate Ovarian Development. Endocrinology, 144 (7), 3237-3243.
Ludbrook, L., & Harley, V. (2004). Sex Determination: A ‘Window’ of DAX1 Activity. Trends in Endocrinology and Metabolism, 15 (3), 116-121.
Matson, C., Murphy, M., Sarver, A., Griswold, M., Bardwell, V., & Zarkower, D. (2011). DMTR1 Prevents Female Reprogramming in the Postnatal Mammalian Testis. Nature, 476 (7358), 101-105.
Oxford English Dictionary. (2011). Default (Noun).
Persani, L., Rossetti, R., Cacciatore, C. & Bonomi, M. (2009). Primary Ovarian Insufficiency: X Chromosome Defects and Autoimmunity. Journal of Autoimmunity, 33 (1), 35-41.
Richardson, S. (2013). Sex Itself: The Search for Male and Female in the Human Genome. Chicago: The University of Chicago Press.
Schiebinger, L. (1989). The Mind Has No Sex? Women in the Origins of Modern Science. Cambridge: Harvard University Press.
Schmidt, D., Ovitt, C., Anlag, K., Fehsenfeld, S., Gredsted, L., Treier, A., & Treier, M. (2004). The Murine Winged-Helix Transcription Factor Foxl2 is Required for Granulosa Cell Differentiation and Ovary Maintenance. Development, 131 (4), 933-942.
Sekido, R., & Lovell-Badge, R. (2009). Sex Determination and SRY: Down to a Wink and a Nudge? Trends in Genetics, 25 (1), 19-29.
Sekido, R., & Lovell-Badge, R. (2008). Sex Determination Involves Synergistic Action of SRY and SF1 on a Specific Sox9 Enhancer. Nature, 453, 930-934.
Shaikh, M., Boyes, L., Kingston, H., Collins, R., Besley, G., Padmakumar, B., Ismayl, O., Hughes, I., Hall, C., Hellerud, C., Achermann, J., & Clayton, P. (2007). Skewed X Inactivation is Associated with Phenotype in a Female with Adrenal Hypoplasia Congenita. Journal of Medical Genetics, 45 (9), 1-5.
Sinclair, A., Berta, P., Palmer, M., Hawkins, J., Griffiths, B., Smith, M., Foster, J., Frischauf, A., Lovell-Badge, R., & Goodfellow, P. (1990). A Gene from the Human Sex-Determining Region Encodes a Protein with Homology to a Conserved DNA-Binding Motif. Nature, 346, 240-245.
Stevens, N. (1905). A Study of the Germ Cells of Aphis Rosae and Aphis Oenotherae. Journal of Experimental Zoology, 2 (3), 313-333.
Swain, A., Narvaez, V., Burgoyne, P., Camerino, G., & Lovell-Badge, R. (1998). Dax1 Antagonizes Sry Action in Mammalian Sex Determination. Nature, 391 (6669), 761-767.
Tannour-Louet, M., Han, S., Corbett, S., Louet, J., Yatsenko, S., Meyers, L., Shaw, C., Kang, S., Cheung, S., & Lamb, D. (2010). Identification of De Novo Copy Number Variants Associated with Human Disorders of Sexual Development. Public Library of Science (PLoS) Biology, 5 (10), e15392, 1-13.
Turnbull, C., Rapley, E., Seal, S., Pernet, D., Renwick, A., Hughes, D., Ricketts, M., Linger, R., Nsengimana, J., Deloukas, P., Huddart, R., Bishop, D., Easton, S., Stratton, M., Rahman, N., & The United Kingdom Testicular Cancer Collaboration (2010). Variants near DMRT1, TERT, and ATF7IP are Associated with Testicular Germ Cell Cancer. Nature Genetics, 42 (7), 604-607.
Uhlenhaut, N., Jakob, S., Anlag, K., Eisenberger, T., Sekido, R., Kress, J., Treier, A., Klugmann, C., Klasen, C., Holter, N., Riethmacher, D., Schütz, G., Cooney, A., Lovell-Badge, R., & Treier, M. (2009). Somatic Sex Reprogramming of Adult Ovaries to Testes by FOXL2 Ablation. Cell, 139 (6), 1130-1142.
Veitia, R. (2010). FOXL2 Versus SOX9: A Lifelong “Battle of the Sexes.” BioEssays, 32 (5), 375-380.
Vilain, E. (2009). X-Linked Adrenal Hypoplasia Congenita. In Pagon, R., Dolan, C., & Stephens, K. (eds.), Gene Reviews. Seattle: University of Washington Press.
Welt, C. (2007). Primary Ovarian Insufficiency: A More Accurate Term for Premature Ovarian Failure. Clinical Endocrinology, 68 (4), 499-509.
Wilson, E. (1905). The Chromosomes in Relation to the Determination of Sex in Insects.
Science, 22 (564), 500-502.
傳統上生理性別辨識(具雙向分化能力之胚胎生殖腺分化為睪丸或卵巢的過程)的研究著重於睪丸發育。Andrew Sinclair1990年發表於自然的文章確認了一個可做為生理性別辨識區域Y (SRY)的Y染色體基因。相反地,女性性發育則被認為是在Sry基因不存在之下的「預設」發育過程。在生理性別辨識的個案中,「預設性」發育過程變成女性發育途徑的主要概念;亦即卵巢會導致其他作用的缺乏。卵巢發育的主動控制過程仍為盲點。女性「被動」發育的概念在更廣義的社群中符合現今科學理論與社會性別假設。
性別化創新:
大約在2010年,對「預設」概念的質疑導致發現一串卵巢功能所需之基因。而社會性別分析的結果產生三項在這個領域的創新研究法:
-
將卵巢發育視為主動發展過程。這些研究也增加了睪丸發育以及卵巢和睪丸發育途徑如何相互作用的知識(參見圖)。
-
發現正在進行之卵巢和睪丸的維持過程。卵巢發育途徑的研究顯示,轉錄調節因子FOXL2必須表現於成人之卵巢濾泡以避免「將成人卵巢轉分化為睪丸」。接著,研究人員發現,為避免睪丸之塞特利氏細胞被重新編碼為顆粒細胞,轉錄因子DMRT1的存在是必要的。
-
以新語言描述生殖腺分化過程。當男性與女性發育過程有所差異時,研究人員已經放棄「預設」概念並強調,男性與女性發育過程雖有差異,但卵巢建立過程實為主動發育過程(如同建立睪丸或其他任何器官發育過程的概念)。每條發育路徑都由一連串複雜的基因產物以適當劑量在精準的時機串連而成。
