幹細胞:
分析生理性別
議題
在人類研究中,生理性別通常被當作一種變因處理。動物研究的生理性別分析很罕見,細胞實驗更是少之又少(Beery等人,2011)。這類研究的缺乏代表著,我們將失去了解生物學基本原理與發育過程的機會,也無法進而改進細胞療法。
方法:分析生理性別
我們應該要分析任何層級上的生理性別,從染色體、細胞到生物個體皆是。一些將生理性別列入考量的研究已經引領幹細胞領域創造出新的問題。生理性別分析包含:
- 設定實驗時,以足夠的兩性細胞偵測或排除生理性別差異 (並非所有生理性別差異都是有意義的)。
- 發表實驗結果時,要載明細胞的生理性別。
- 紀錄、編排與分析數據以促成系統性文獻回顧和綜合性分析 (meta-analysis)的進行。文獻回顧能辨識知識上的歧異(例如只採用單一生理性別細胞的實驗)。綜合性分析能提高統計的效力,即使缺乏兩性的研究,也可能可以進行生理性別分析。
性別化創新:
- 辨別幹細胞特性的生理性別差異。 動物模式的研究已證明幹細胞的生理性別在治療時會影響相關的細胞性狀,像是增生與分化的速率。
- 暸解 XX 與 XY 幹細胞之內與之間的差異性。 遺傳學、內分泌環境與表觀遺傳學 (epigenetics) 交互作用的新發現都增進了我們對幹細胞生物學的認識。
- 改進幹細胞治療的臨床準則。 透過研究問題的制定,在探討造血幹細胞 (hematopoietic stem cell) 移植捐贈者與受贈者生理性別的重要性 (同時包含其他與生理性別交互影響的因素)時,研究人員能收集相關數據,並藉此改進幹細胞治療的臨床準則。
議題
性別化創新 1:辨別幹細胞特性的性別差異
性別化創新 2:了解 XX 與 XY 幹細胞之內與之間的差異性
方法:交織性研究方法
性別化創新 3:改進幹細胞治療的臨床準則
方法:形成研究問題
結論
下一步
議題
考量生理性別的研究能提升幹細胞的基礎知識,闡明治療效力上的與受體中介路徑中的生理性別差異。在幹細胞研究中特別活躍的領域:把取自成人身上的細胞誘導出多功能性並利用這些細胞修復或重建器官,幹細胞生物學的基礎知識尤為重要。
性別化創新 1:辨別幹細胞特性的性別差異
以生理性別作為變因的研究已經發現一些成人幹細胞的生理性別差異,包含:
-
間質幹細胞 (Mesenchymal Stem Cell,MSC) 活化的差異
間質幹細胞能從骨髓及其他組織分化而來,再分化成骨頭、脂肪、肌肉、結締組織與軟骨 (Oreffo等人,2005)。Crisostomo 等人闡明了間質幹細胞活化時的生理性別差異。研究人員針對實驗鼠進行體外缺氧、脂多醣 (lipopolysaccharide, LPS) 與雙氧水處理時,發現這些活化反應會因生理性別而異:XX 細胞相較於 XY 細胞能產生較多血管內皮生長因子 (vascular endothelial growth factor,VEGF,一種能促進細胞增生的因子) 且較少腫瘤壞死因子-α (tumor necrosis factor alpha,TNFα,一種能促進細胞發炎與細胞凋亡的因子) (Crisostomo等人,2007)。 -
肌源性幹細胞 (Muscle-Derived Stem Cell,MDSC) 再生能力 (Regenerative Capacity) 的差異
MDSCs 具有修復心肌與骨骼肌的能力,同時還能治療當今治療效果有限的肌肉萎縮症 (muscular dystrophy) (Jankowski等人,2002)。
MDSC 細胞株展現再生力的變異性。研究採用自發性肌肉萎縮症的 mdx實驗小鼠。Deasy等人闡明,細胞的生理性別獨立於其他變因,像是免疫反應與外源性雌激素(exogenous estrogenic)作用,且能對再生力造成強烈的效用。而這項差異的背後機制仍是當今研究的顯學。
Deasy等人發現,體內模式的再生力有顯著的生理性別差異。XX細胞比XY細胞產生較高的再生指數(regeneration index,RI)。體內研究的事實是,mdx實驗小鼠的肌纖維缺乏肌肉萎縮蛋白(dystrophin)。於是研究人員對幹細胞產生的肌纖維進行定量(與肌肉萎縮蛋白一併定量),並藉此測量 RI 值。即使所有的 MDSCs 都能在體外模式時分化成表現肌肉萎縮蛋白的肌纖維,但只有 XX MDSCs 能穩健地在體內模式再生(Deasy等人,2007)。
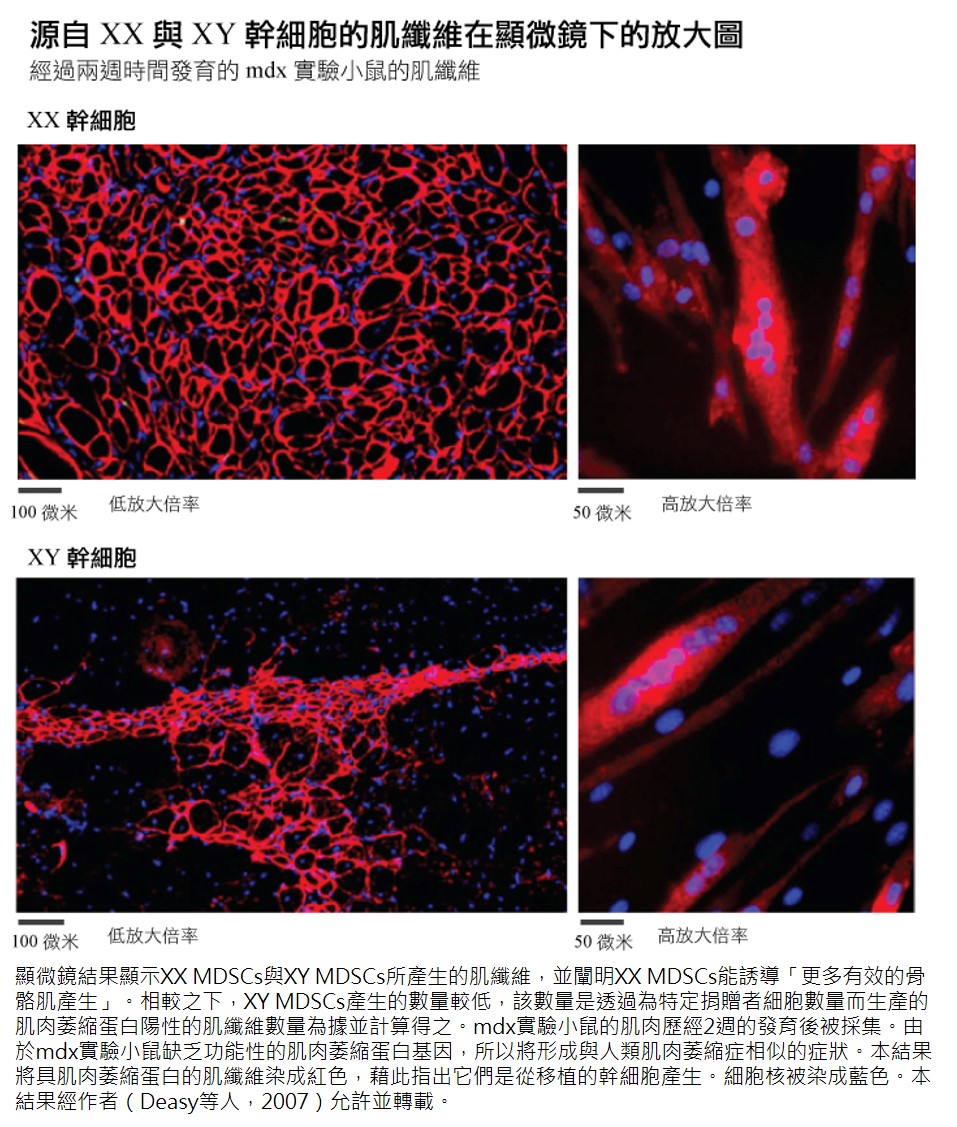
生理性別差異或許與治療方式有重大相關性。但除了生理性別因素外,仍有許多變因會影響細胞行為。而「理想的」細胞性狀又會依治療方式而有所差異。因此這些差異並不表示特定生理性別的細胞在廣泛的治療模式中,都一律優於另一生理性別的細胞。幹細胞的臨床研究中,「科學家執行明確定義之臨床疾病模式時,缺乏針對不同細胞型的直接比較」 (Zenovich等人,2007)。
性別化創新 2:暸解 XX 與 XY 幹細胞之內與之間的差異性
當研究人員理解幹細胞的生理性別差異時,他們試圖去解釋造成差異的原因,進而需要分析更多因素 (參見方法)。
方法:交織性研究方法
研究人員分析生理性別時觀察到 XX 與 XY 幹細胞的差異,但對幹細胞生物學進一步的理解還需對共變項 (covariates) 的檢驗。可由幾種面向觀察到生理性別差異:
見總方法
- 遺傳學:由於雌性與雄性的幹細胞有不同的核型(karyotype),所以會有不同的遺傳性狀。但同一生理性別的細胞間也會發生遺傳變異,也就是並非所有的XX細胞或XY細胞都是一樣的。在幹細胞研究中,遺傳型(genotype)共變項的研究、生理性別間差異與生理性別內差異的分析,都是十分重要的。
- 賀爾蒙環境:幹細胞對於賀爾蒙環境十分敏感,像是性激素。由於賀爾蒙對幹細胞有暫時性與永久性作用,所以它對於生理性別而言是一種必要的共變項(Asselin-Labat等人,2010)。
- 表觀遺傳學:幹細胞的 DNA 序列在細胞的生命週期中是固定不變的,只有在很少的情況下會受環境因素而改變。不過基因的表現卻能經常性且戲劇性地改變,這就解釋了為何基因相同的幹細胞卻有能力分化成功能相異的體細胞。即便細胞在相同的賀爾蒙環境下進行體外模式培養,這些改變仍具可遺傳性,所以這些差異並無法單以根源自遺傳訊息而表現的假定來解釋。因此,前代細胞發育的環境中有可能已經存在表觀遺傳的差異,而這些差異亦是重要的共變項 (Ohm等人,2009)。
多變項研究將生理性別視為諸多變項的其中一項。檢驗生理性別與其它研究成果預測因子的交互關係是重要的。如果沒有進行這項檢驗,我們可能誤將實際上由其他因素造成的差異歸因到生理性別變項上。此種錯誤歸因會導致生理性別差異被過度強調。共變項分析的結果如下:
-
物種會影響幹細胞行為,所以動物模式的研究成果並不一定適用於人類。
舉例來說,當誘導實驗鼠的XX纖維母細胞(fibroblasts)的細胞多功能化特性時,繼而出現的誘導多功能性幹細胞(induced pluripotent stem cells,iPSCs)會反轉X染色體不活化(X inactivation)的現象,並出現兩個活化的X染色體。而當人類的XX纖維母細胞進行細胞多功能化特性誘導時,繼而出現的人類iPSCs會表現一個活化與一個X染色體不活化的現象(Tchieu等人,2010)。 -
在肌肉萎縮症的小鼠模式中,捐贈者細胞與受贈者動物生理性別皆有關聯。
多變項分析證明 XX MDSCs 較 XY MDSCs 促進更多再生力 (不考量受贈者生理性別),且雌受贈者動物較雄性產生更多再生力 (不考量捐贈者生理性別)。不過在肌肉萎縮症的 mdx 小鼠模式中,配對捐受雙方的生理性別對促進肌肉再生而言並不是個理想的策略,因為XX 幹細胞對兩種生理性別的動物而言都是個更好的治療選項 (Deasy等人,2007)。免疫缺陷小鼠的實驗指出,宿主生理性別的作用(非細胞性別的作用)能被免疫調節:研究人員在免疫缺陷的動物中,「並沒有觀察到宿主生理性別造成的結果有顯著差異」,但「細胞生理性別造成的結果卻有顯著差異」(Deasy等人,2007)。
-
即便性別是統計上有意義的幹細胞行為預測因子,但並非所有相同生理性別的細胞株也都相同。
像是同生理性別的小鼠 MDSCs 在再生力的潛能表現出顯著的變異性 (Deasy等人,2007)。17株研究常見的人類胚胎幹細胞 (其中9株為46,XX,8株為46,XY) 研究證明,不同細胞株擁有不同發育傾向,會發展為特定類型(Osafune等人,2008)。而這些特徵無法單以核型的性型態來預測(Cowan等人,2004)。
-
賀爾蒙環境與幹細胞生理性別的交互作用。
賀爾蒙與幹細胞的關係是複雜的。不管是體內或體外模式,都需將細胞或其前代發育時的賀爾蒙環境以及當下的環境列入考量。Ray等人(2008)的評論闡明,性激素會對許多種類的幹細胞的特徵產生作用,並依細胞類型而有所不同。
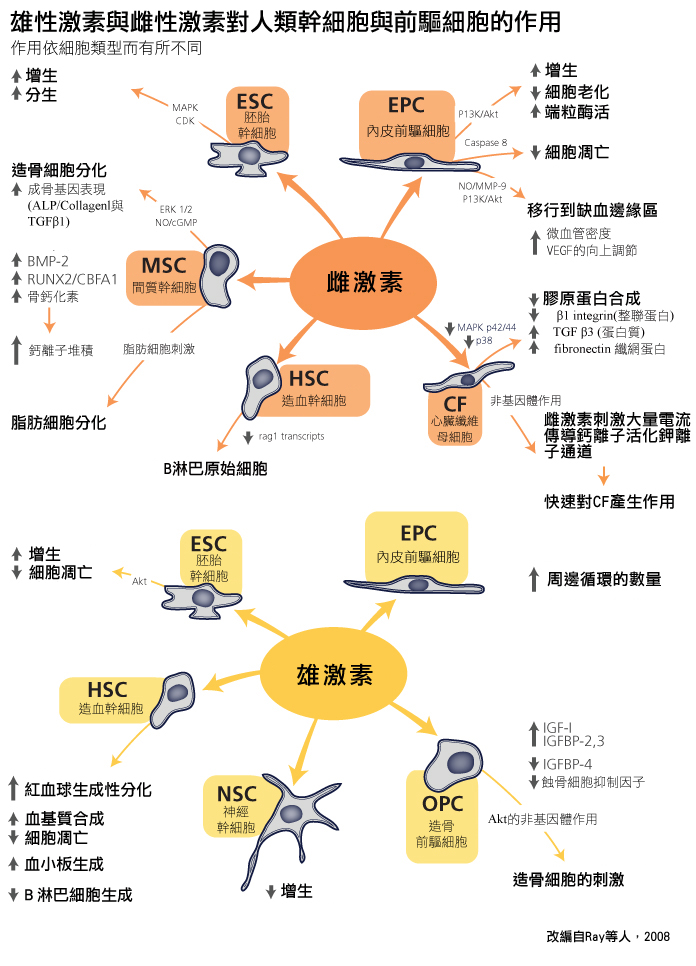
性別化創新 3:改進幹細胞治療的臨床準則
當一位病患的自身幹細胞無法用於治療時,幹細胞移植成功的關鍵就要仰賴以下幾點的交互作用分析:1) 捐贈者的細胞生理性別;2) 宿主的生理性別;3) 受移植之幹細胞類型;4)接受治療的疾病 (參見方法)。
方法:形成研究問題
物種、幹細胞生理性別、受贈者生理性別與賀爾蒙和免疫上的變因,這幾項因素在動物實驗與體外實驗的研究中有彼此間交互作用的新發現。這些發現促使研究人員去制定幹細胞治療相關的問題。以目前而言,現有唯一的標準常規幹細胞療法是造血幹細胞(hematopoietic stem cell,HSC)移植。該療法主要用以治療癌症與免疫缺陷或再生不良性貧血(aplastic anemia)(Gratwohl等人,2010)。
見總方法
一份關於移植的研究指出,捐受雙方的生理性別配對與較佳的總體存活有關,不過來自雄性捐贈者的造血幹細胞與較佳的長期存活有關。該研究共有1,386名病患於同一醫學中心進行異體造血幹細胞移植。其中約有 75%為白血病(Pond等人,2006)。
以兒童白血病的造血幹細胞移植而言,女性捐贈男性是不適宜的方式,「相較於其他生理性別組合,會產生不利的結果」,「人類白血球抗原錯配 (Human Leukocyte Antigen Mismatch,MM) 是悲傷的結果」。亦發現孕期捐贈者會與捐受雙方的生理性別產生交互作用,當源自孕期捐贈者的幹細胞給予男性病患時,移植物抗宿主病 (graft-versus-host disease,GVHD) 的風險將提高 (Gustaffson等人,2004)。
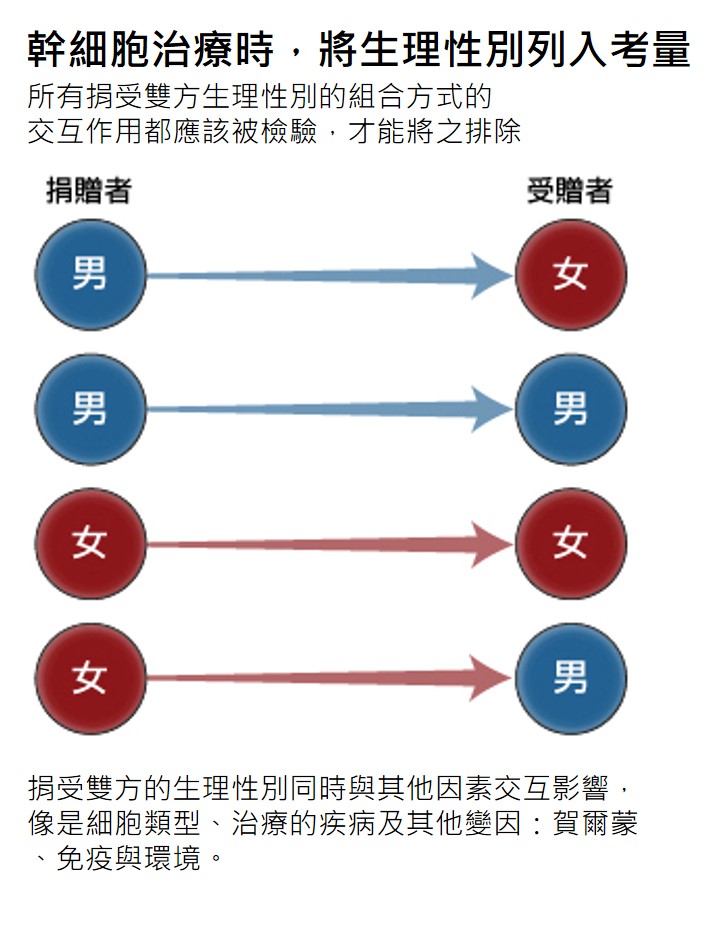
捐受雙方的生理性別同時與其他疾病型態的共變項交互影響—舉例來說,當以 HSC 移植治療多發骨髓瘤 (multiple myeloma) 時,女性捐贈者的細胞可能產生較佳的結果。女性病患接受女性造血幹細胞會比接受男性的造血幹細胞有較低死亡率。以多發骨髓瘤的男性病患而言,捐贈者細胞生理性別並沒有顯著影響總體死亡率,但仍會影響死亡模式:男性病患以男性造血幹細胞治療時有較高機率發生骨髓瘤復發性死亡,而男性病患以女性造血幹細胞治療時,則有較高機率發生非復發性死亡,像是移植物抗宿主病 (Gahrton等人,2005)。
為了使移植結果最佳化,造血幹細胞異體移植的病患配對系統現在開始會將捐受雙方的生理性別與其他變因列入考量 (Lee等人,2007)。
結論
在細胞層次從事生理性別分析和報告的研究者已辨識出細胞行為中的生理性別差異,並將其關聯到發展中的治療模式。這些發現引領著研究人員探討生理性別差異的原因並發現賀爾蒙與遺傳因素對幹細胞的調節能力。至於造血幹細胞的移植—全球臨床使用中唯一的幹細胞治療方式—臨床學者已累積一些關於捐贈者生理性別、受贈者生理性別與其他共變項間交互作用的數據,並藉此最佳化異體移植時捐受雙方的配對方式。
下一步
以基礎研究而言,科學家在發表研究成果時應該要意識到生理性別作為一種變因的重要性,並針對所使用的細胞核型進行判別。實驗的結果與無結果(null results)都應該被發表(參見分析生理性別)。無論生理性別差異是否存在,發表細胞的核型結果是重要的,因為這些資訊才能促成進一步的研究回顧與統合分析。 經費補助機構 與 期刊編輯 都可以藉由經費補助與發表指南鼓勵這類發表行為。
參考資料
Asselin-Labat, M., Vaillant, F., Sheridan, J., Pal, B., Simpson, E., Yasuda, H., Smyth, G., Martin, T., Lindeman, G., & Visvader, J. (2010). Control of Mammary Stem Cell Function by Steroid Hormone Signaling. Nature, 465 (7299), 798-802.
Beery, A., & Zucker, I. (2011). Sex Bias in Neuroscience and Biomedical Research.
Neuroscience and Biobehavioral Reviews, 35 (3), 565-572.
Cowan, C., Klimanskaya, I., McMahon, J., Atienza, J., Witmyer, J., Zucker, J., Wang, S.,
Morton, C., McMahon, A., Powers, D., & Melton, D. (2004). Derivation of Embryonic Stem-Cell
Lines from Human Blastocysts. New England Journal of Medicine, 350 (13), 1353-1356.
Crisostomo, P., Markel, T., Wang, M., Lahm, T., Lillemoe, K., & Meldrum, D. (2007). In the
Adult Mesenchymal Stem Cell Population, Source Gender Is a Biologically Relevant Aspect of
Protective Power. Surgery, 142 (2), 215-221.
Deasy, B., Lu, A., Rubin, R., Huard, J., Tebbets, J., Feduska, J., Schugar, R., Pollett, J.,
Sun, B., Urish, K., Gharaibeh, B., & Coo, B. (2007). A Role for Cell Sex in Stem
Cell-Mediated Skeletal Muscle Regeneration: Female Cells Have Higher Muscle Regeneration
Efficiency. The Journal of Cell Biology, 177 (1), 73-86.
Gahrton, G., Iacobelli, S., Apperley, J., Bandini, G., Björkstrand, B., Bladé, J., Boiron, J.,
Cavo, M., Cornelissen, J., Corradini, P., Kröger, N., Ljungman, P., Michallet, M., Russell, N.,
Samson, D., Schattenberg, A., Sirohi, B., Verdonck, L., Volin, L., Zander, A., &
Niederwieser, D. (2005). The Impact of Donor Gender on Outcome of Allogeneic Hematopoietic Stem
Cell Transplantation for Multiple Myeloma: Reduced Relapse Risk in Female to Male
Transplants. Bone Marrow Transplantation, 35 (6), 609-617.
Gratwohl, A., Baldomero, H., Aljurm, M., Pasquini, M., Bouzas, L., Yoshimi, A., Szer, J.,
Lipton, J., Schwendener, A., Gratwohl, M., Frauendorfer, K., Niederwieser, D., Horowitz, M.,
& Kodera, Y. (2010). Hematopoietic Stem Cell Transplantation: A Global Perspective.
Journal of the American Medical Association, 303 (16), 1617-1624.
Gustaffson, Å., Remberger, M., Ringdén, O., & Winiarski, J. (2004). Risk Factors in
Pediatric Stem Cell Transplantation for Leukemia. Pediatric Transplantation, 8 (5),
464-474.
Jankowski, R., Deasy, B., & Huard, J. (2002). Muscle-Derived Stem Cells. Gene Therapy,
9 (10), 642-647.
Lee, S., Klein, J., Haagenson, M., Baxter-Lowe, L., Confer, D., Eapen, M., Fernandez-Vina, M.,
Flomenberg, N., Horowitz, M., Hurley, C., Noreen, H., Oudshoorn, M., Petersdorm, E., Setterholm,
M., Spellman, S., Weisdorf, D., Williams, T., & Anasetti, C. (2007). High-Resolution
Donor-Recipient HLA (Human Leukocyte Antigen) Matching Contributes to the Success of Unrelated
Donor Marrow Transplantation. Blood, 110 (13), 4576-4583.
Ohm, J., & Baylin, S. (2009). Stem Cell Epigenetics. In Rajasekhar, V., & Vemuri, M.
(Eds.), Regulatory Networks in Stem Cells, Volume III: Stem Cell Biology and Regenerative
Medicine, pp. 235-246. Berlin: Springer Science and Business Media.
Oreffo, R., Cooper, C., Mason, C., & Clements, M. (2005). Mesenchymal Stem Cells: Lineage,
Plasticity, and Skeletal Therapeutic Potential. Stem Cell Reviews, 1 (2), 169-178.
Osafune, K., Caron, L., Borowiak, M., Martinez, R., Fitz-Gerals, C., Sato, Y., Cowan, C.,
Chien, K., & Melton, D. (2008). Marked Differences in Differentiation Propensity among Human
Embryonic Stem Cell Lines. Nature Biotechnology, 26 (3), 313-315.
Pond, G., Lipton, J., & Messner, H. (2006). Long-Term Survival after Blood and Marrow
Transplantation: Comparison with an Age- and Gender-Matched Normative Population. Biology of
Blood and Marrow Transplantation, 12 (4), 422-429.
Ray, R., Novotny, N., Crisostomo, P., Lahm, T., Abaranell, A., & Meldrum, D. (2008). Sex
Steroids and Stem Cell Function. Molecular Medicine, 14 (7), 493-501.
Tchieu, J., Kuoy, E., Chin, M., Trinh, H., Patterson, M., Sherman, S., Amiuwu, O., Lindgren,
A., Hakimian, S., Zack, J., Clark, A., Pyle, A., Lowry, W., & Plath, K. (2010). Female Human
Induced Pluripotent Stem Cells (iPSCs) Retain an Inactive X Chromosome. Cell, 7 (3),
329-342.
Zeller, C., Wang, Y., Markel, T., Weil, B., Abarbanell, A., Herrmann, J., Kelly, M., Coffey,
A., & Meldrum, D. (2009). Role of Tumor Necrosis Factor Receptor 1 in Sex Differences of
Stem-Cell-Mediated Cardioprotection. Annals of Thoracic Surgery, 87 (3), 812-819.
Zenovich, A., Davis, B., & Taylor, D. (2007). Comparison of Intracardiac Cell
Transplantation: Autologous Skeletal Myoblasts versus Bone Marrow Cells. In Kauser, K., &
Zeiher, A. (Eds.), Bone Marrow-Derived Progenitors, pp. 117-165. Berlin: Springer
Verlag.
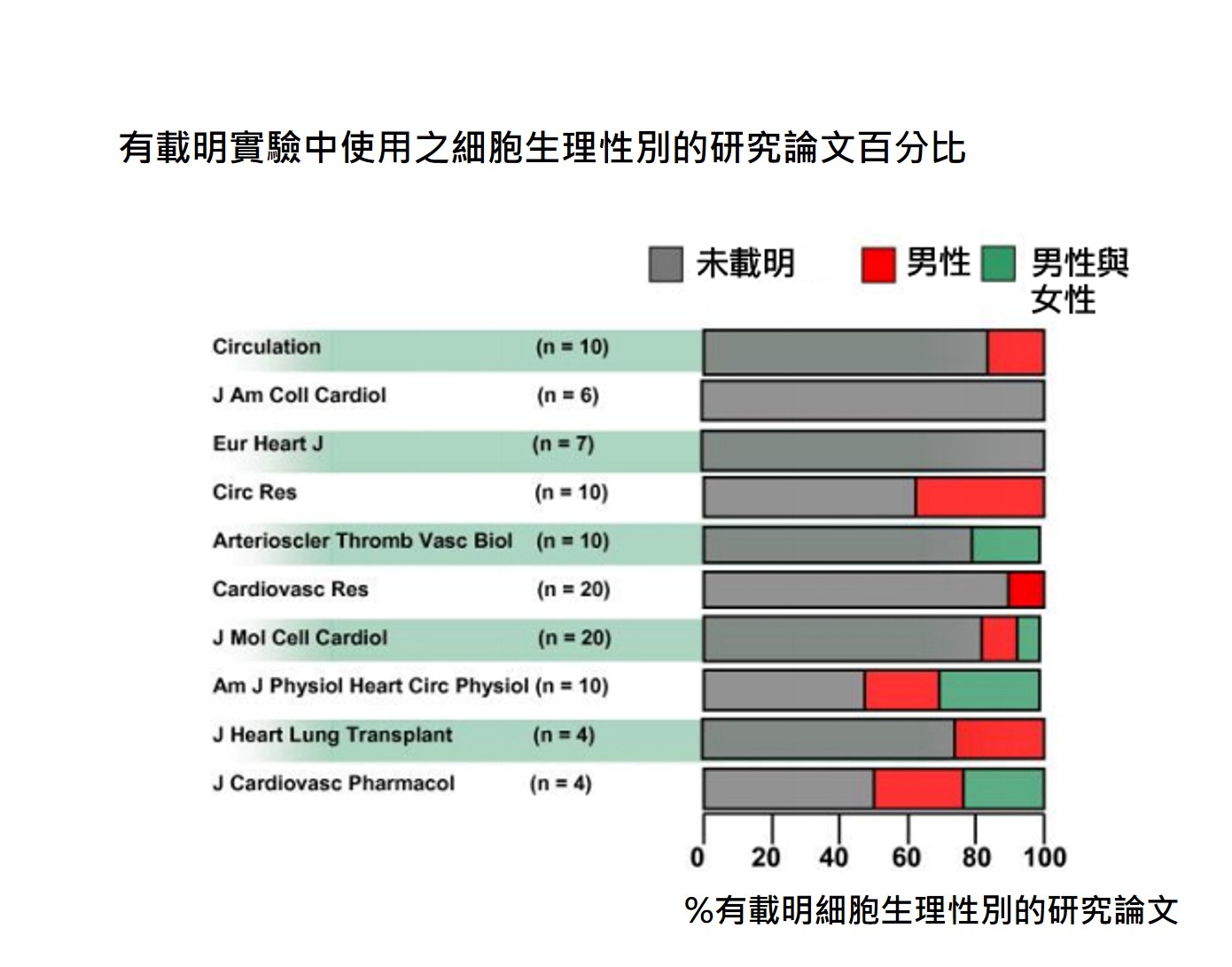
一篇2011年在梅奥醫院(Mayo Clinic)進行的研究指出,絕大多數的基礎研究都沒有載明細胞的生理性別(參見圖表)。沒有針對細胞生理性別進行分析的研究是浪費經費的研究,更喪失了未來對綜合性分析的貢獻。
以幹細胞治療虛弱病症 (debilitating diseases) 是極有希望的,像是帕金森氏症與肌肉萎縮症。然而,研究人員若不將細胞生理性別列入考量將造成危及性命的結果並留下未解決的謎題。舉例來說,一宗挪威與澳洲實驗室的國際合作案曾面臨小鼠骨髓幹細胞的問題。一開始研究人員採用兩種生理性別的小鼠(優越的實驗設計),但他們卻沒緣由地只使用雌性幹細胞。這種無意識決定正反映出研究人員的不良實驗規範。造成的結果就是他們的雄性小鼠死亡,而他們仍不知道原因為何。
學術界已經對幹細胞治療能力的潛在生理性別差異做了記錄,舉例而言,源自肌肉的幹細胞在增生與分生時展現出變異性。研究人員發現,XX細胞比XY細胞表現較高的再生力。此發現或許能建構出重要的臨床發現,不過仍須更多的研究。

研究人員在排除生理性別這項變因前,應考量所有捐受雙方之生理性別交互作用的組合方式。這種捐受雙方的分析在人類器官移植時也是同等重要。
性別化創新
當時挪威與澳洲實驗室若有考量所有可能的生理性別組合造成的捐受交互作用,他們的實驗就能擁有更偉大的科學成就。不過科學研究也不該僅止於此,仍有許多變因應受檢驗,像是幹細胞類型、被治療的疾病與賀爾蒙及環境因素。這些變因都會與生理性別交互作用而影響結果。
